Электрон массасы m=9,1*10-31 кг-ға тең және табиғаттағы ең жеңiл сутегi атомы массасынан 3700 еседей аз болып шықты. Электр зарядын арттыруға және азайтуға болады. Яғни олар әр түрлі мәнге ие болуы мүмкін. Ендеше электр заряды физикалық шама. Екі электрометр алып олардың біреуін зарядтайық. Сосын оқшаулағыш тұтқасы бар жіңішке сыммен екі электрометрді жалғайық. Сонда біз зарядтың теңдей екіге бөлінгенін көре аламыз. Атом құрылысы 1911жылы ағылшын ғалымы Э. Резерфорд басқарған тәжiрибелер нәтижесiнде ашылған. Электрон заряды терiс: qэл = – е = – 1,6 • 10–19(дәрежесі) Кл.
Бұл заряд электронның ерекше сипаттамасы болып табылады. Жәй денелердi зарядтауға немесе разрядтауға болады, ал электронды зарядынан “айыру” мүмкiн емес. Сондай-ақ электрон зарядын азайтуға немесе көбейтуге болмайды. Электрон заряды барлық уақытта тек бiр мәнге ие. Химия курсынан сiздер электронның атом құрамына кiретiнiн бiлесiздер. Электрондар атом ішінде орналасқан оң зарядталған атомдық ядроны айнала қозғалады. Резерфорд тәжiрибелерiн жоғары сыныптарда егжей-тегжейлi қарастырылады. Мұнда бiз оның тәжiрибе нәтижесiнде жасаған қорытындыларымен шектелемiз.[3]
Атом құрылысы[өңдеу]
Резерфорд атомының құрылысын Күн жүйесiне ұқсатты. Күн жүйесiндегiпланеталар оған тартылып айналғаны сияқты, электрондар да ядроғатартылып оны айнала қозғалады. Осындай ұқсастығы үшiн Резерфорд ұсынған модельдi планетарлық модель деп атаған. Ядро мен электронның ара қашықтығы олардың өлшемдерiне қарағанда өте үлкен. Егер атомды ойша үлкейткенде ядроның диаметрi он теңгелiктей болса, онда ядро мен электрон ара қашықтығы шамамен бiр километрдей болар едi. Егер барлық электрондар атомдық ядроларға тығыз орналасса, онда ересек адамның денесiнiң көлемi бiр куб миллиметрдiң миллионнан бiр бөлiгiндей болатындығы есептелген. Бұдан адам денесiнiң 99%-ын (кез-келген дененiң) бостық жайлайтындығын көремiз. Бiр тектi атомдар жиынтығы химиялық элемент деп аталады. Әр түрлi химиялық элементтердiң атомдары бiр-бiрiнен ядроларының зарядымен және сол ядроны айнала қозғалатын электрондар санымен ерекшеленедi. Мысалы, сутегi атомында жалғыз электрон бар, оттегi атомында – сегiз электрон, ал уран атомында – тоқсан екi. Атомдағы электрондар саны элементтiң Д.И. Менделеев кестесіндегі реттiк нөмiрiмен сәйкес келедi. Осы нөмiр атом ядросының зарядын да анықтайды. Белгiлеу енгiзейiк: Z – элементтiң реттiк нөмiрi, е = атомдағы электрондар саны. Онда атом ядросының және атомдағы барлық электрондардың жалпы заряды үшiн былай жазуға болады: qядро = + Ze, qэл-н = – Ze. Атомдағы электрондардың жалпы зарядын, атом ядросының зарядына қоссақ нөл шығады. Бұл атомның толықтай бейтарап екендiгiн көрсетедi. Бейтарап атомдардан тұратын заттардың молекулалары да бейтарап болады. Кейбiр жағдайларда (мысалы, соқтығысқанда) атомдар бiрнеше электронын жоғалтуы мүмкiн. Атомдар электрондармен бiрге өздерiнiң терiс зарядының бiр бөлiгiн жоғалтып, бейтарап емес жүйеге айналады. Осының салдарынан пайда болған оң зарядталған атомды оң ион деп атайды. Керi жағдайлар да болуы мүмкiн: бейтарап атом өзiне артық электрон қосып алып, терiс зарядталады. Мұндай атомды терiс ион деп атайды.
2. Тұздар: құрамы, жіктелуі, қасиеттері, алынуы 92 бет.
Тұздар – химиялық қосылыстар класы; қышқыл молекулаларындағы сутек атомдарының орны толықтай немесе жартылай металл атомдары не ОН топтарына ауысқан қосылыстар; қалыпты жағдайда иондық құрылымдағыкристалл заттар.[1]
' Тұздар - Тұздар - қатты кристал заттар, біразы суда жақсы еріп, мөлдір ерітінді түзеді. Суда ерімейтін тұздарға BaCO3,BaSO4,AgCl, және тағы басқлары жатад. Азот қышқылының тұздары түгелдей суда ерімтал. Натрий мен калий тұздарының барлығы дерлік суда жақсы ериді.
Тұздар ерте заманнан белгілі. 1812 жылы Я.Берцелиус тұздардың электрхимиялық теориясын құрды. Электролиттік диссоциациялану теориясы шыққаннан кейін, тұздардың суда ерігенде металл атомдары катиондарын және қышқыл қалдығы аниондарын түзетін күрделі заттар екені анықталды. Мысалы, NaNO3Na+1+NO Û31.-
3. 20%-тік 500г ерітінді даярлау үшін қанша грамм тұз қанша грамм су қажет?
Шешуі:
Массалық үлесті табу формуласы бойынша тұздың (заттың) массасын табамыз
500г*0.2=100г
Судың массасы 500г-100г=400г
Жауабы: 100 грамм тұз және 400 грамм тұз қажет.
№15 Билет
1. Химиялық элементтердің жіктелуі мысалдар келтіріп заттардың формуласын жазыңдар.
Ғылымның кез келген саласында деректердің жиналып молаюына байланысты, оларды жіктеп, жүйелеу мен өзарабайланыстарын айқындау жұмысы жүреді.
Химиялық элементтерді жіктеудің қажеттігі туды, себебі олардың саны XIX ғасырдың басынан біртіндеп арта бастады. Сондықтан оларды қасиеттеріне қарай топтастыру жұмысы басталды. Жіктеу элементтерді металдар менбейметалдарға бөлуден басталды; оны шведтің ұлы ғалымы Й.Я. Берцелиус жүзеге асырды. Олардың генетикалыққатарлары мынадай:
металдар → негіздік оксидтер → негіз бейметалдар → қышқылдық оксидтер → қышқыл
Енді нағыз металл мен бір бейметалды алып, олардың өздерінің және қосылыстарының қасиеттерін салыстырасипаттайық: мысалы, натрий мен күкіртті алсақ:
1) Натрий - металл, металдық жылтыры бар, электр тоғы мен жылуды жақсы өткізеді. Ал күкірт - сары түсті ұнтақ зат, бейметалл - жылу мен электр тоғын өткізбейді.
Ал қосылыстарының қасиеттерін салыстырып көрсек:
2) Натрий оксиді Na2О - негіздік оксид, оған суда еритін негіз (сілті) сәйкес келеді (NaOH).
Күкірт оксидтері SО2, SО3 қышқылдық оксидтер, оларға қышқылдар H2SО3, H2SО4 сәйкес келеді.
3) Оксидтерінің химиялық қасиеттерін еске түсірсек: Na2О + Н2О = 2NaOH Na2О + SО3= Na2SО4 Na2О + H2SО4= Na2SО4+H2О
SО3+H2О=H2SО4 SО3+CaO = CaSО4 SО3+2NaOH = Na2SО4+H2О
4) Қышқылдарды анықтайтын индикаторлар:
көк лакмус → қызарады метилоранж → қызарады
Негіздерді анықтайтын индикаторлар:
метилоранж → сарғаяды фенолфталеин → таңкурай түске боялады
Осы екі үлкен қатардан басқа олардың аралығында орналаса алатын қосылыстарының қасиеттері екіжақтыэлементтер де көптeн табыла бастады (Zn, Al, Be).
Бериллий оксиді тұз қышқылымен әрекеттескенде негіздік оксидтің қасиетін көрсетеді:
ВеО + 2HCl = ВеСl2+ Н2O
ВеО + 2NaOH= Na2BeO2+ Н2O
Екінші реакцияда ВеО қышқылдық оксидтің қасиетін көрсетіп, екідайлылық танытады.
Екідайлы оксид пен гидроксид түзетін металдардың өздері де екі түрлі қасиет көрсетеді; мысалы, беткі қабатыжаңадан тазартылған алюминий кесегі қышқылмен де, сілтімен де сутегін бөле әрекеттеседі.
2Al+6NaOH=2Na3AlO3+3H2↑
2Аl+6НСl=2АlСl3+ЗН2↑
Аl2O3+6НСl=2АlСl3+ЗН2O
Al2O3+6NaOH=2Na3AlO3+3H2O
Оксидіне сәйкес гидроксиді де екідайлы қасиет көрсетеді.
Аl(OН)3+ЗНСl=АlСl3+ЗН2O
Al(OH)3+3NaOH=Na3AlO3+3H2O
Осы мысалдардан элементтерді металдар мен бейметалдар деп нақты бөлуге болмайтынын көреміз.
Табиғатта қасиеттері ұқсас элементтер кездеседі, оларды элементтердің табиғи топтары деп атайды. Мысалы,галогендер — фтор, хлор, бром, йод. Олардың молекулалары екі атомды, нағыз бейметалдар (Ғ2, Cl2, Br2, I2).
Олардың барлығы ұшқыш сутекті қосылыстар береді, ерітінділері қышқылдар. Салыстырмалы атомдық массаларының мәндері артқап сайын әлементтердің белсенділіктері кемиді.
Галогендер сияқты элементтердің тағы бір табиғи тобы - халькогендер. Олардың салыстырмалы сипаттамаларынқарастырамыз.
Халькогендердің химиялық реакциялардағы белсенділіктері галогендерге карағанда төмендеу. Салыстырмалыатомдық массалары артқан сайын сутекті қосылыстарының тұрақтылығы кемиді, ал оксидтері - қышқылдык оксидтер, оларға сәйкес қышқылдарының қышқылдылығы әлсірейді.
Қасиеттері карама-қарсы топсілтілік металдар тобы — литий, натрий, калий, рубидий, цезий. Бұлардың молекулалары бір атомды, өте активті, оңай балқитын, сумен шабытты әрекеттесетін, қосылыстарында бір валенттілік көрсететін әлементтер.[1]
2. Жай және күрделі заттардың жіктелуі. Генетикалық байланысты қалай қалпына келтіруге болады? Металдар және бейметалдар.
Химиялық формула – заттың құрамын химиялық элемент таңбалары және индекстер көмегімен шартты түрде бейнелеу.
Заттың салыстырмалы молекулалық массасы, берілген зат молекуласының массасы көміртек атомы массасының 1/12 бөлігінен неше есе ауыр екенін білдіреді.
Химиялық формула арқылы салыстырмалы молекулалық массасын табамыз:
Мr (H2O) = (2•1)+16=18
Заттың формуласы бойынша мыналарды білуге болады:
1. Жай немесе күрделі зат.(бір немесе бірнеше атом түрлерінен құралғандығын)
2. Сапалық құрамы (яғни атомдардың қандай түрлерінен құралған)
3. Сандық құрамы (яғни әр атом түрінің қаншасы кіреді)
4. Салыстырмалы молекулалық массасы (яғни берілген молекула массасы м.а.б-нен неше есе көп)
5. Элементтердің массалық қатынастары.
Химиялық формула – заттың құрамын химиялық элемент таңбалары және индекстер көмегімен шартты түрде бейнелеу.
Заттың салыстырмалы молекулалық массасы, берілген зат молекуласының массасы көміртек атомы массасының 1/12 бөлігінен неше есе ауыр екенін білдіреді.
Химиялық формула арқылы салыстырмалы молекулалық массасын табамыз:
Мr (H2O) = (2•1)+16=18
Заттың формуласы бойынша мыналарды білуге болады:
Жай немесе күрделі зат.(бір немесе бірнеше атом түрлерінен құралғандығын)
Сапалық құрамы (яғни атомдардың қандай түрлерінен құралған)
Сандық құрамы (яғни әр атом түрінің қаншасы кіреді)
Салыстырмалы молекулалық массасы (яғни берілген молекула массасы м.а.б-нен неше есе көп)
Элементтердің массалық қатынастары.
Металдар – Электр тоғы мен жылуды жақсы өткізетін, пластикалық қасиеті жоғары, жылтыр заттар. Мұндай қасиеттердің болуы металдардың ішкі құрылымымен байланысты.
Металдардың (сынаптан басқа) кристалдық тор көздерінде металл атомдарыорналасқан. Олар бір-бірімен металдық байланыспен байланысады. Металдардың иондану энергиясы аз болғандықтан олардың валенттік электрондары оңай бөлініп, бүкіл кристалдың бойында еркін қозғала алады. Сондықтан олардың жиынтығын электрон газы деп те атайды. Су ерітінділеріндегі реакциялар үшін металдың активтілігі оның активті қатардағы орнына байланысты.
Металдардың қаттылығы, температураға төзімділігі күнделікті тәжірибеде шешуші рөл атқарады. Егер шыныхроммен кесілсе, ал цезийді адам тырнағымен-ақ кесе алады. Кейбір металдар жұмсақ (күміс, алтын, т.б.) болғандықтан таза металдардың орнына олардың бір-бірімен құймалары қолданылады. Ең алғаш алынған құймалардың бірі – қола.
Темір мен оның құймалары (шойын, болат) қара металдар, ал қалғандары түсті металдар; алтын, күміс, платинахимиялық реактивтерге төзімділігіне байланысты асыл металдар; сумен әрекеттесіп сілті түзетін металдарды сілтілік (Lі, Na, K, Rb, Cs), ал жер қыртысының негізін құрайтындарын сілтілік жер металдар; массалық үлесі 0,01%-дан аспайтындарын сирек металдар деп атайды. Өнеркәсіпте металдарды негізінен пирометаллургия,гидрометаллургия және электрметаллургия әдістерімен алады. Металдар электр сымдарын, тұрмысқа қажет бұйымдар (қазан, балға, т.б.) жасауда, т.б. кеңінен қолданылады.
Бейметалдар - металл еместер қатарына: сутек, бор, көміртек, кремний, фосфор, мышьяк, оттек, күкірт, селен, теллур, галогендер, асыл газдар жататын химиялық элементтер тобы; оларды металдардан бөліп топтауға қолданылатын атау. Табиғаттағы белгілі бейметалдар саны металдарға қарағанда аса көп емес. Периодтық жүйедегі бейметалдардың орнын анықтау үшін бор элементінен астатка дейін көлденең сызық жүргізсе, кестенің жоғарғы оң жақ бұрышын ала негізгі топшаларда бейметалдардың орналасқаны байқалады. Периодта бейметалл әлемент атомының ядро заряды біртіндеп өседі де, атом мөлшері кішірейеді. Сондықтан электрон қосып алуға бейімділігі жоғары және тотықтырғыштық қасиеті басым болады. Ал бейметалл орналасқан негізгі топшаларда (IV—VII) атомның радиусы неғұрлым кіші болса, ол ең сыртқы электрондарды күшті тартады. Демек, тотықтырғыштық қасиеті басым болады. Мысалы, фтор мен хлор атомын салыстырсақ, ең күшті тотықтырғыш — фтор. Бейметалдардың тотықтырғыш қабілеті электртерістіктің сан мәніне байланысты. Тотықтырғыш қасиеттердің өзгеруіндегі осы заңдылық сол бейметалдар түзетін жай заттарға да тән.
3. Массасы 12,6 г азот қышқылын бейтараптау үшін мыс(II) гидроксиді қанша массасы және мөлшері қажет екенін есептеңдер.
Шешуі:
12,6г хг
2HNO3+Cu(OH)2=Cu(NO3)2+H2O
126 98
m(Cu(OH)2)=(12,6×98)/126= 9,8г
12,6 хмоль
2HNO3+Cu(OH)2=Cu(NO3)2+H2O
126 1моль
х=12,6/126= 0,1
немесе есепті шығаруының 2-ші жолы:
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
63 г азот қышқылының мольдік массасы n HNO3=12,6/63=0.2 моль
Реакция былай жүреді: 2 HNO3 + Cu(OH)2 ----> Cu(NO3)2 + 2 H2O.
Реакциядан айқын көрінетіні мыс гидрооксидінің (II) мольдер саны азот қышқылының мольдік санынан 2 есе аз болуы тиіс, яғни 0,1 моль.
n Cu(OH)2-0,2/2=0.1 моль
Енді мольдік массаға көбейтеміз
m Cu(OH)2=0,1*(64+2*17)=9,75 г.
№16 Билет
1. Химиялық элементтердің электр терістігі ұғымдарының айырмасы неде?
Периодтық жүйедегі әр период бекзат газбен аяқталады. Олар химиялық, белсенділігі төмен газдар, осы енжарлықты шешу үшін олардың электрондық құрылыстарына үңілейік. Атомдық кұрылыстары бізге белгілі 42He, 2010Ne, 4018Аr газдардың барлырының сыртқы электрондық қабаттары аяқталған 8 электронды.
Бұлардан басқа элементтердің химиялық белсенділіктері осы сыртқы электрондық қабаттарының аяқталмағандығынан болады. Олар енді қосылыс түзу арқылы ғана осындай аяқталған қабатқа (инерттілікке) электрондарын беру немесе электрондарды қосу арқылы жетеді. Ал мұның өзі екі жайтқа тәуелді:
1. элементтердің электрондық құрылысына;
2. атом радиусына.
Периодтың басында орналасқан элементтің сыртқы қабатындағы электрондар саны аз болады, сондықтан олар осы электрондарын беріп жіберіп, өзіне дейін тұрған бекзат газдың аяқталған электрондық құрылысын алады. Ал периодтың соңын ала орналасқан элементтердің сыртқы қабатындағы электрондар саны көп болғандықтан, аяқталуға жетпей тұрған электрондарды қосып алып, өзінен кейін тұрған бекзат газдың электрондық қабатын алады.
Период бойынша элементтердің сыртқы қабатындағы электрондар (валенттілік электрондар) саны біртіндеп артады, атомдардың ядро зарядтары да осы бағытта өседі. Атомдардың электронды өзіне тарту күші солдан оңға қарай артады, сондықтан атом радиустары осы бағытта кемиді. Яғни осы бағытта электронды сыртқы қабатына қосу мүмкіндігі артады.
Үшінші периодта орналасқан элементтердің валенттілік электрондарының формулаларын жазып, олардағы дара электрондар сандарын және электрондық қабаттың аяқталуына қанша электрон калғандығын анықтап көрелік.
Toп бойынша осы қасиеттің өзгерісін карастырайық. Бір топта орналаскан элементтердің валенттілік электрондарының сандары бірдей, ал электрондық қабат саны, яғни атом радиустары жоғарыдан төмен қарай артады; олай болса, сыртқы қабаттарынан электрондарды беріп жіберуге бейімділіктері артады.
Электрондарды беру металдың, ал қосу бейметалдық қасиеттерді сипаттайды.
Осыны түсіну үшін бірінші және жетінші топтың негізгі топшаларында орналасқан бізге белгілі элементтердің электрондық құрылыстары мен атом радиустарының мәндерінің арасындағы байланысты қарастырайық.
Сонымен, период бойынша солдан оңға қарай металдық қасиет кеміп, бейметалдық біртіндеп артады; ал топ бойынша жоғарыдан төмен қарай металдық қасиет артады.
Электртерістілік дегеніміз элемент атомдарының байланыс түзу кезінде өзінің сыртқы қабатына электрондарды тарту арқылы аяқталған электрондық қабат түзу мүмкіндігі.
Іс жүзінде салыстырмалы электртерістілік деген түсінік қолданылады, бұл түсінікті ғылымға американ ғалымы JI. Полинг кіргізген, оның мәні 0,7 мен 4,0 аралығында өзгереді. Электртерістілік мәні ең аз элемент - цезий, ал ең жоғары электртерістілік көрсететін элемент - фтор.
2. Ерігіштік дегеніміз не? Ерігіштік өлшемін қандай шам алар арқылы анықталады?
Ерігіштік — заттың белгілі бір еріткіште еру қабілеті. Белгілі бір жағдайдағы заттың ерігіштігінің сипаттамасы ретінде оның қаныққан ерітіндідегіконцентрациясы алынады. Сондықтан ерітіндінің құрамын қалай сипаттаса, ерігіштікті де сан жағынан солай сипаттайды. Мысалы, заттың белгілі бір температурада белгілі бір еріткіштегі ерігіштігін оның қаныққан ерітіндісіндегі еріген заттың массалық үлесімен не оның молярлық концентрациясымен (моль/л) сипаттауға болады. Ерігішті көбінесе, еріткіштің 100 массалық бірлігінде қаныққан ерітінді түзілгенше еритін еріген заттың масса бірлігімен көрсетеді. Оны кейде ерігіштік коэффициенті деп те атайды. Заттардың судағы ерігіштегі әр түрлі. Егер 100 г суда еритін заттың массасы 10 г-нан асса — жақсы еритін, 1 г-нан кем болса — нашар еритін, 0,01 г-нан аз болса — іс жүзінде ерімейтін зат деп есептеледі. Заттардың Ерігіштігін алдын ала болжауға мүмкіндік беретін теориялар әзірге жасалған жоқ. Дегенмен химиктер кейбір заңдылықтарды байқады. Мысалы, молекулалары полюсті немесеиондық байланыспен байланысқан заттар (су, спирт, сұйық аммиак) полюсті еріткіштерде жақсы еритіндігі, ал молекулалары полюссіз заттар (бензол,күкіртті көміртек) полюссіз еріткіштерде еритіндігі анықталды. “Ұқсас заттар бір-бірінде жақсы ериді” деген ескі қағида осы заңдылықты тұжырымдайды. Сонымен қатар заттар ерігенде мынадай құбылыстар байқалады: жылу бөлінеді не сіңіріледі, ерітіндінің көлемі азаяды (көлемнің контракциясы) және түсі өзгереді. Осы құбылыстардың барлығы еріген зат пен еріткіш молекулалары арасында химиялық әрекеттесулер бар екендігіне дәлел.
3. Массасы 620г натрий оксиді әрекеттескенде сілтінің қандай массасы және қанша мөлшері түзілетінін есептеңдер.
Шешуі:
Берілгені: m (NaO) =620г Na2O+H2O = 2NaOH Табу керек: m, n (NaOH)? Шешуі: 1) n(Na2O)=m/M=620/23+2 х 16=11моль 2) n(NaOH)=11 х 2=22моль 3) m(NaOH)=n х M= 22 х 40=880г
№17 Билет
1. Заттың аморфты және кристалды жүйелері
Аморфты зат (гр. а — жоқ; гр. morphe — пішін, форма; гр. substantia — зат) — борпылдақ дәнекер ұлпасы жасушалары мен талшықтарының аралықтарын толтырып тұратын, атқаратын қызметіне сәйкес қоймалжындығы өзгеріп отыратын гел тәрізді іркілдек пішінсіз масса. Әртүрлі мүшелердегі борпылдақ дәнекер ұлпасы жасушааралық тірі затындағы негізгі аморфты заттың мөлшері мен химиялық құрамы сол ұлпаның қызметі мен жағдайына байланысты ұдайы өзгеріп отырады. Негізгі аморфты зат — гликозаминді гликандардан, протеинді гликандардан, гликопротеидтерден, судан жөне түрлі бейорганикалық тұздардан тұрады. Бұлардың ішінде аморфты зат қүрамының негізін сульфаттанбаған гликозаминді гликандардың күрделі полимерлі түрі - гиалурон қышқылы құрайды. Бұл қышқылдың ұзын тармақталған полимерлі тізбегі әртүрлі бағытта иіліп, аралықтарында ұяшықтары мен өзектері болатын молекулалық тор жасайды.
Кристалдар – атомдары мен молекулалары кристалдық тор түзетін қатты денелер. Кристалдар (грекше krystallos, оның алғашқы мағынасы мұз дегенді білдіреді) қатты денелердің тепе-теңдік күйі болып табылады. Белгілі бір термодинамикалық (қысым, температура) жағдайда кристалдық күйде болатын химиялық заттың нақты, тек өзіне тән кристалды атомдық құрылымы болады. Бұл құрылым атомдардың орналасуына байланысты кристалдардың сыртқы симметриясын және олардың анизотропиялық қасиеттерін бейнелейді. Табиғатта және техникада кездесетін қатты материалдардың көпшілігі – поликристалдар. Олар ретсіз орналасқан ұсақ кристалдардан (кристалиттер) құралады. Бұған көптеген минералдар, техникалық металдар мен қорытпалар жатады. Кристалдардың жеке ірі түрі монокристалл деп аталады. Табиғатта салмағы жүздеген килограмға жететін кварц, дала шпаты, флюорит кристалдарымен қатар мөлшері өте ұсақ алмас кристалы да кездеседі. Термодинамикалық тепе-теңдік жағдайда өсірілген кристалдардың пішіні белгілі бір симметриялы, дұрыс көпжақ түрінде болады. Олардың жақтары жазық болып келеді де, қырлары түзу сызық бойымен тұрақты бұрыш жасай қиылысады, яғни кристалдану кезінде кристалдардың жақтары өзіне-өзі параллель жылжиды. Бұл заңдылық геометриялық кристаллографияда бұрыштардың тұрақтылық заңы деп аталады. Геометриялық кристаллографияның ІІ заңы – бүтін сандар заңы — кристалдық заттардағы микропериодтылықтың макроскопиялық көрінісі болып табылады. Кристалдық тордың кез келген атомдық жазықтығы координаттық осьтер бағытында тор периодының бүтін сандарымен сипатталады. Кристалдың жақтары симметриялы болады, жақтары мен қырлары бір-бірімен симметрия амалдарының нәтижесінде беттесе алады. Әрбір амал симметрия осіне, жазықтығына не центріне байланысты орындалады. Кристалдық көпжақтар да симметрияның белгілі бір элементтерінің жиынтығымен сипатталады. Симметрияның 32 класы (32 нүктелік тобы) бар. Әрбір класс симметрияның белгілі бір элементтерімен сипатталады. Кристалдық тордың ерекшелігіне қарай кристалдың сыртқы пішіні белгілі бір класқа және сингонияға бөлінеді. Температураның не қысымның өзгеруіне байланысты кристалдардың құрылымы да өзгереді. Кейбір кристалды күйлер (фазалар) метастабильді (салыстырмалы тұрақты) күйде болады. Берілген зат құрылымының әр түрлі бірнеше кристалдық фазада болуы полиморфизм (мысалы, ақ және сұр қалайы, алмас және графит, кварцтың түрлері, т.б.) деп аталады. Қатты кристалдарға қарағанда, сұйық кристалдар мен аморфты денелерде (мысалы, шыны) атомдардың орналасу тәрітібі нашар сақталады. Кристалдардың өсуі кезіндегі тепе-теңдік шарттарының бұзылуы, кристалдану кезінде қоспалардың араласуы тәрізді әр түрлі әсерлердің салдарынан кристалдың идеал құрылымында ауытқулар байқалады. Кристалдық тор атомдарының орнын басатын аз мөлшерде қоспа атомдарын өндіру тәсілі кристалдың қасиеттерін өзгерту үшін техникада кең қолданылады. Мысалы, Al2O3 хром қосу арқылы кванттық электроникада пайдаланылатын лағыл (рубин) алынады. Кристалдардың бірқатар қасиеттері (жылулық, серпімділік, акустикалық) атомдардың өзара әсеріне байланысты анықталады. Мысалы, графитте атомдар жеке қабаттар түрінде орналасады. Оның көршілес екі қабаты арасындағы қашықтық бір қабаттағы атомдар арасындағы қашықтықтан үлкен болады. Сондықтан деформация кезінде графит жеке қабаттар бойынша біртіндеп ыдырайды. Бұл құбылыс графитті қарындаш ретінде пайдалануға мүмкіндік береді. Кристалдар электроникада, оның ішінде, кванттық электроникада ерекше орын алады. Аса қатты кристалдар (алмас, т.б.) материалдарды өңдеуде және бұрғылау ісінде пайдаланылады. Лағыл, сапфир, т.б. кристалдар сағат және басқа да дәл өлшеуіш аспаптардың негізгі элементі болып есептеледі.
2. Ерітінділер концентрациясы дегеніміз не және оны қандай тәсілдермен көрсетуге болады? Тұздардың алыну жолдары...
Ерітіндінің концентрациясын химияда әр түрлі тәсілдермен көрсетуге болады. Мысалы: проценттік, молярлық, т.б.Ерітіндінің концентрациясын көрсететін ең қарапайым әдіс проценттік концентрацияны қарастырайық. Күнделікті өмірде және іс жүзінде ерітіндінің концентрациясы процентпен көрсетіледі.
Ерітіндідегі еріген заттың массалық үлесі дегеніміз- еріген зат массасының ерітінді массасына қатынасы болып саналады.
Тұздарды алу жолдары:
1) Металл мен бейметаллдан: Мg + Сl 2 = Мg СI 2
2) Негіздік оксид пен қышқылдық оксидтен: МgО + ЅО 3 = Мg ЅО 3
3) Негіздік оксид пен қышқылдар: СаО+ 2 НСІ = CāCỊ 2 + H 2О
4) қышқылдық оксид пен негіздің әрекеттесуінен: СО 2 + Са (ОН) 2 = CаCO 3 + H 2О
5) қышқыл мен негіздің бейтараптануынан H 2SО 4+2NaОH =Νa 2ЅО 4+H 2О
6) Тұз бен қышқылдың әрекеттесуінен: Ва СІ 2 + Н 2 ЅO 4 =BaЅО 4 + 2HCI
7) Тұз бен тұздың әрекеттесуінен СaCI 2+Аg 2СО 3=СaСО 3+ 2AgCI \
8) Тұз бен сілтінің әрекеттесуінен CūЅО 4+2ŃaОH= Ńa 2ЅO 4+ Cū(OH) 2
9) металдың қышқылмен әрекеттесуінен Zň+2HCĪ=ZňCĬ 2 +H 2
10) металл мен тұз әрекеттесуінен: Си + НgCI 2=CuCI 2+ Hq
3. Массасы 7,4 г кальций гидрооксиді қанша грамм фосфор қышқылымен әрекеттеседі.
Шешуі:
7,4 х
Ca{OH}2 + H3PO4
74 98
x= 7.4*98/74= 9.8 грамм
№18 Билет
1. Кристалл торларының түрлері және оның түйіндері дегеніміз не? Заттардың қасиеттерінің құрылысына тәуелділігі
Кристалдық тордың базисіндегі бөлшектердің орналасуы, олардың табиғаты мен өзара әсерінің сипатына тығыз байланысты. Бірақ барлық жағдайда, кеңістік тордың түйіндеріндегі бөлшектер, өзара әсерлесу энергиясы ең кіші мәнге ие болатындай шартта жайғасады.
Егер, көрші молекулалардың әсерлесуі кезіндегі центрлерінің ең жақын ар қашықтығы d, ro қаықтықтан үлкен болса, молекулалардың арасындағы тартылыс күштері басым жәнеолардың жалпы потенциалдық энергиясы теріс. Ал кері жағдайда, яғни, молекулалар біріне- бі рі жақындаған сайын олардың арасындағы тебіліс күштері – оң күштер арта бастайды және потенциялдық энергиялары жоғарылайды. Көбінесе бұл тебіліс күштері электрондар емес атом ядроларының есебінен пайда болады. Екі молекулалардың ара қашықтығы ro ге теңелгенде олардың жалпы потенциялдық энергиясы минимум болады, яғни, молекулалардың арасындағы тебіліс күштер және тартылыс күштері теңеледі.
Жалпы, атомдар мен молекулалардың арасындағы әсерлесу күштері, гравитациялық және магниттік күштердің өте аздығына байланысты, таза электрлік деп саналады. Кристалдық тордың түйіндеріндегі атомдардың арасындағы химиялық байланыс энергиясы, олардың сыртқы қабаттарындағы валенттік электрондардың есебінен жүзеге асады.
Бұл химиялық байланыс энергиясының мөлшері электростатикалық байланыс энергиясымен шамалас, яғни, 10-10 Дж жуық екендігі білінеді.
Периодтық жүйеде элементтер, олардың атомдарындағы электрондар мен ядролардың әсерлесу сипатына сәйкес, екі топқа бөлінеді. Бірінші топқа сыртқы валенттік электрондары өзінің ядросымен әлсіз байланысқан элементтер,мысалы, сілтілі металдар жатады. Бұлар валенттік электрондарынан оңай айырылып, оң иондарға айналады. Электронды атомнан жұлыпалуға тең энергия байланыс энергиясы деп аталады және ол электронвольтпен өлшенеді.
Екінші топқа сыртқы валенттік электрондар саны төрттен асатын элементтер жатады. Электронды қосып алу энергиясы өте жоғары элементтер галоидтар.
Жалпы кристалдарды, өзара әсерлесу сипатына сәйкес, бір бөлшекке келетін байланыс энергиясы 0.1-ден 7 эВ аралығында өзгеріп отырады. Бұл энергия кристалдан электронды бөліп алу жұмысының мөлшерін көрсетеді. Кристалдар, өздерін құрайтын бөлшектердің табиғатына және олардың өзара әсерлесу сипатына төрт құрылымды төрге бөледі.
Кристалдық тордың түйіндернде орналасқан бөлшектердің табиғатына және бөлшектердің арасындағы әрекеттесу күштерінің сипатына байланысты кристалдық торларды төрт түрге бөледі және осыған баййланысты кристалдардың төртеуі бар:
1. иондық
2. атомдық
3. металдық
4. молекулалық
I Иондық кристалдар. Кристалдық тордың түйіндерінде түрліше таңбалы иондар орналасқан. Олардың арасындағы өзара әрекеттесу күштері негізінен электірлық (кулондық) болып табылады. Түрліше зарядталған иондардың арасындағы электростатикалық тартылыстан туатын байланыс гетерополярлық немесе иондық деп аталады. Иондық тордың мысалы ас тұзының (Na Cl) торын келтіруге болады. Бұл тор кубтық жүйеге жатады. Ақ шеңбер шектер оң зарядталған натрий иондары да, ал қара шеңбер шектерімен хлордың теріс иондары белгіленген. Иондық кристалл молекулалардан емес иондарынан тұрады. Тұтас кристаллды аса зор бір молекула деп қарастыруға болады.
II Атомдық кристаллдар. Кристаллдық тордың түйіндерінде бейтарап атомдар орналасқан. Кристаллдағы бейтарап (сонымен молекуладағы да) атомдарды байланыстыратын байланыс гомеополярлық немесе коваленттік деп аталады. Гомеополярлық байланыс күштері де электірлік сипатта болады (бірақ кулондық емес). Ол күштерді тек кванттық механика негізінде ғана түсіндіруге болады.
III Металдық кристаллдар. Кристаллдық тордың барлық түйіндерінде металдың оң иондары орналасқан. Олардың арасында газ молекулаларына ұқсас, иондар түзілген кезде атомдарда үзіліп қалған электрондар бейберекет қозғалып жүреді. Бұл электрондар оң иондарды шашыратпай ұстап тұратын «цемент» рөлін атқарады; басқаша болса, оң иондар арасындағы тебілу күштерінің әсерінен тор быт-шыт болған болар еді. Сонымен қатар иондар да электрондарды сыртқа шығармай тор ішінде ұстап тұрады.
Металдың көпшілігінің торларын негізіне үш түрге жатады: көлемдік, центрленген куб, жағы центрленген куб және тағы тығыз гексогоналдық деп аталатын торлар.
IV молекулалық (торлар) кристаллдар. Кристаллдық тордың түйіндерінде белгілі түрде бағдарланған молекулалар орналасады. Кристаллдағы молекулалардың арасындағы байланыс күштерінің тегі де газдарды идеалдықтан ауытқытатын молекулалар арасындағы тартылыс күштерімен бірдей. Сол себебтен оларды Ван-дер-вальстық күштер депатайды. Мысалы, мына заттардың молекулалық торлары болады: H2 , N2,O2, CO2,H2 O. Сөйтіп, байырғы мұз да, құрғақ мұз да (қатты көмір қышқыл) молекулалық кристаллдар болып табылады екен.
2. Отттекті зертханада қалай алуға болатынын түсіндір.
Калий перманганаттан қыздыру арқылы бөліп алу
Бертолле тұзы арқылы бөліп алады
2КMnO4 -> K2MnO4 + MnO2 +02
а)сынауықтағы сутегі асқын оксидін катализатор(өршіткі) салып қыздыру;
ә) марганец (IY) оксидін сынауықта қыздыру;
б)қоспа дайындау H2O2+MnO2, оттегін алу, тәжірибе нәтижесі қорытын- дыланып, катализаторға анықтама беріледі. Катализаторды бөліп алып, массасы өзгермегенін көрсету керек. Бертолле тұзынан да оттегін алғанда өршіткі қолданылады.
3. Массасы 4,6 г натрийді 150 г суда еріту арқылы алынған ерітіндідегі натрий сілтісінің массалық үлесі
Массасы 4,6 г натрийді 150 г суда еріту арқылы алынған ерітіндідегі натрий сілтісінің массалық үлесі
4,6 г х г у г
2Na + 2H2O = 2NaOH +H2
46 г 36 г 80 г
1. Алдымен натриймен толық өзара әрекеттесуге қанша су кеткенін анықтаймыз:
46 г натриймен толық өзара әрекеттесуге 36 г су жұмсалса, ал
4,6 г натриймен толық өзара әрекеттесуге х г су жұмсалуы тиіс, мұнан
4,6 г_----- х г
х= 4,6*36/46=3,6 г
2. Енді гидрооксид массасын табамыз:
46 г натрийдің толық өзара әрекеттесуінен 80 гидроксид пайда болады, ал
4,6 г натрийдің толық өзара әрекеттесуінен у г гидроксид пайда болуы керек?
4,6 г_----- y г
x=80*4,6/46=8 г
3. Ерітінді массасын анықтаймыз:
m(ерітінді) = m(H2O) + m(NaOH)=(150-3,6)+8=154,4 г.
4. Гидроксид массасын ерітінді массасына бөле отырып мынаны аламыз:
W(NaOH)= m(NaOH)/(m(ерітінді) = 8/154,4 г= 0,05 немесе 5%.
Жауабы: сілті массасы 0,05 немесе 5%.
№19 Билет
1. Ауа-газдар қоспасын қалай түсінесің? Атмосфералық ауаны ластанудан қалай қорғаймыз?
Ауаның құрамына алғаш тәжірибе жасаған француз ғалым А. Лавуазье. Ауаның құрамы:
Құрамды бөліктері
Газдар құрамы
Көлем бойынша Масса бойынша
Азот
Оттегі
Инертті газдар
Көміртек ()оксиді
(көмірқышқыл газы)
38,08
20,95
0,94
0,03
75,50
23,10
1,30
0,046
Жердің ауа қабаты - атмосфера деп аталады. Атмосфера - қажетті табиғи қор. Ал атмосфераны ластайтын заттар өте көп. Әртүрлі өндірістік қондырғылар мен қозғағыштардың шектен тыс жұмыс істеуі,,көліктерден шыққан түтіндер атмосфераның ластануына әкеп соғады,сөйтіп тірі ағзалардың тіршілігіне қауіп тудырады. Өйткені ауа уланып бұзылады. Міне, сондықтан қазіргі уақытта ауаны таза ұстау.ластаудан сақтау және космостық радиация тозаңдарынан қорғау мәселелеріне ерекше мән берілуі орынды.
Адам денсаулығы - қоғамдық құндылық, бірақ адамның іс әрекеті адамзат тіршілік ортасының нашарлауына әкеліп, қазіргі кездің келелі мәселесіне айналып отыр.
2. Зертханада хлордың алыну жолдарын реакциялар теңдеуі арқылы өрнекте.
зертханада 1) 4HCl(конц.) + MnO2 = Cl2↑ + MnCl2 + 2H2O
2) 16HCl(конц.) + 2KMnO4 = 5Cl2↑ + 2MnCl2 + 8H2O + 2KCl
3) 4HCl(конц.) + Ca(ClO)2 = 2Cl2↑ + 32H2O + CaCl2
4) 6HCl(конц.) + KClO3 = 3Cl2↑ + 3H2O + KCl
Хлор газын алу үшін кейбір күшті тотықтырғыштарға, мысалы марганец (ІҮ) оксидіне MnO2 , бертолле тұзына KCIO3 , калий перманганатына KMnO4 концентрлі тұз қышқылымен әсер етіп алады:
Осы әдіспен хлорды алғаш рет 1774 ж. Швед оқымыстысы К. Шееле алған. Бертолле тұзы мен тұз қышқылын өте сақтықпен жайлап қыздырғанда реакция жүреді де хлор газы бөлінеді. Концентрлі тұз қышқылын калий перманганатының ерітіндісіне құйса, реакция шабытты жүреді.
3. Массасы 28 г. литий суда ерігенде сутектің қанша көлемі түзіледі?
Шешуі:
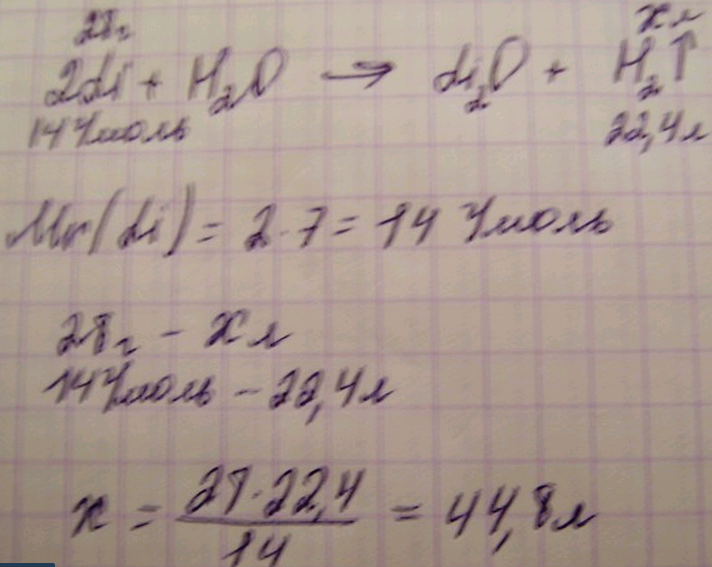
№20 Билет
1. Оттегі химиялық элементінің аллотропиясы қалай аталады? Қандай зат екендігін түсіндір.
Оттегінің аллотропиялық түр өзгерістері. Озон
Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O2, екіншісі O3, ол озон деп аталады. Енді озонмен жете таныссақ, озон найзағай ойнағанда ауада пайда болады. Сонда электр зарядының әсерінен мына реакция жүреді:
3O2 → 2O3
Бір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады.
Озонның формуласы О3, салыстырмалы молекулалық массасы 48, оттегінен 1,5 есе ауыр (48: 32 = 1,5), суда аз еритін, -112°С-да қайнайтын, -193°С-да балқитын газ күйінде қою-көк түсті, ал қатты күйінде көктен қара-күлгін түске дейін боялады.
Озонның химиялық қасиеттері
Озон оттегіне қарағанда химиялық белсенді зат. Ол тіпті алтын, күміс, платина сияқты асыл металдарды да тотықтыра алады (7-кесте).
6Ag + O3 = 3Ag2O
Нөсер жаңбырдан кейін орманға барсақ, онда ауа тазарып дем алу жеңілдейді, себебі ауада пайда болған озон айырылып, ауаны тазартады. Озонның атмосферадағы мөлшері өте аз - 0,004%.
О3 → O2 + "О"
Озоннан молекулалық және атом күйіндегі оттек бөлінеді, соңғысы күштірек тотықтырғыш, ауадағы бактерияларды жояды. Озон осы қасиетіне қарай ауыз суды, құдыктарды, өндірістік сарқын суларды тазарту үшін (залалсыздандыру) және ағартқыш зат ретінде қолданылады. Атмосфераның жоғары қабатында, жерден 25 км биіктікте (стратосферада) күн сәулесінің әсерінен жерді қорғап тұратын өте жұқа озон қабаты әр түрлі кері әсерлердің салдарынан «тесіліп», сол жерлерден күннің ультракүлгін сәулелері жер бетіне жетіп, ондағы әр түрлі табиғи апаттарға әкеліп соғады. Олар: жер бетінің температурасының біртіндеп артуы, мәңгілік мұздақтар мен мұхиттардағы мұзтауларының еруі, терінің қауіпті ісігі көбейеді. Озонды зертханада озонатор деп аталатын құралда алуға болады.
Оттегі мен озонның салыстырмалы сипаттамалары
Оттегі (O2) Озон (O3)
Ауадан сәл ауыр, түссіз, иіссіз, суда нашар еритін газ (20°С-да судың 100 көлемінде оттегінің 3 көлемі, ал 0°С-да 5 көлемі ериді. Тыныс алу, жану, тотығу, шіру үдерістеріне қатысады. Ашық көк түсті өзіне тән иісі бар, суда жақсы еритін, ауадан 1,655 есе, оттегіден 1,5 есе ауыр газ. Озон оттегіне қарағанда химиялық белсенділігі жоғары зат, бактерицидтік, ағартқыштық қасиеттері бар. Ол озонның ыдырауы нәтижесінде атом күйіндегі оттек бөлінуімен түсіндіріледі: O3 ↔ O2 + "O". Концентрациясы 10-5%-дан артқанда улы болады.
Табиғатта озон найзағай жарқылдаған кезде және кейбір органикалық заттар тотыққанда түзіледі (Озоносфера қабаты). Таза озон – улы, микроорганизмдерді өлтіреді, сол себепті суды, ауаны дезинфекциялауда, күшті тотықтырғыш болғандықтан қағаз ағартуда, т.б. қолданылады.
2. Тотықтырғыш және тотықсыздандырғыш туралы түсінік
Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш болып есептеледі.
Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады.
Электрондардың тотықсыздандырғыштан тотықтырғышқа тасымалдануы барысында белгілі бір атомның, молекуланың немесе ионның тотығу дәрежесі өзгереді және тотығатын заттың тотығу дәрежесі жоғарылайды, ал тотықсызданатын заттікі-төмендейді.
Тотығу-тотықсыздану реакцияларын теңестірудің екі тәсілі бар, электронды баланс және ионды-электронды тәсілдері. 2 тәсілдің де негізі бірдей: ол-тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрондардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт.
Электронды баланс тәсілі:
Na 2SO3+KmnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
Реакция кезінде тотығу дәрежесі өзгеретін элементтерді тауып, олардың үстіне жазамыз:
+4 +7 +6 +2
Na 2SO3+KMnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
ТОТЫҚСЫЗДАНДЫРҒЫШ ТОТЫҚТЫРҒЫШ
S+4-2e=S+6
Mn+7+5e=Mn+2
Тотығу және тотықсыздану процесіне қатысушы заттардың коэффициенттері электрондық баланс тәсілінің шарты бойынша тотықсыздандырғыш берген, тотықтырғыш қосып алған электрондар санына тең болады:
5S+4-2e=S+6
2Mn+7+5e=Mn+2
Негізгі тотықтырғыштар мен тотықсыздандырғыштар. Медицинада қолданылуы. Практикада көп қолданылатын аса маңызды тотықтырғыштарға металл еместер (F2, Cl2, Br2, I2, O2), калий перманганаты KmnO4, калий дихроматы мен хроматы K2Cr2O7, K2CrO4, азот қышқылы және оның тұздары, концентрлі H2SO4, галогендердің құрамында оттегі бар қышқылдары және олардың тұздары (KClO3 -калий хлораты және KClO–гипохлориті), және жоғары тотығу дәрежедегі металл иондары, сутек ионы +1тотығу дәрежесінде (негізінен қышқылдардың құрамында).
Аса маңызды тотықсыздандырғыштарға кернеу қатарында сутектен бұрын орналасқан активті металдар (сілтілік және сілтілік жер металдар, Zn, Al, Fe), сондай-ақ кейбір металл еместер H2, C, P, Si, галогенсутектер, күкіртсутек(HCl, HBr, HI, H2S) және кейбір төменгі зарядты металл иондары (Sn2+, Fe2+, Cu+) жатады.
3. Массасы 0,1 моль барий хлориді қанша моль күкірт қышқылымен әрекеттесе алады?
Шешуі:
BaCl2+H2SO4=BaSO4+2HCl
Олардың қатынасы 1:1 тең, сондықтан 0,1 моль барий хлориді 0,1 моль күкірт қышқылымен әрекеттесе алады.
Жауабы: 0,1 моль барий хлориді 0,1 моль күкірт қышқылымен әрекеттесе алады.
№21 Билет
1. Табиғаттағы судың маңызы және физикалық/химиялық қасиеті және қолданылуы
Су — сутегі мен оттегінің қалыпты жағдайларда тұрақтылығын сақтайтын қарапайым химиялық қосылысы. Ауыз су, тіршілік көзі, ол Жер шарының 3 / 4 бөлігін алады, тірі ағзалардың 60-70%-ы, ал өсімдіктердің 90 % -ы судан тұрады.[1]
Жер бетінде тіршілік ең алғаш сулы ортада пайда болды. Су — бүкіл тіршілік иелерінің негізгі құрамдас бөлігі. Бұдан басқа судың тіршілік үшін физикалық-химиялық қасиеттердің: жоғары жылу өткізгіштік және жылу сыйымдылық, жоғары тығыздық, ауа тығыздығының шамамен 800 есе артуы, мөлдірлік, тұтқырлық, қатқан кезде мұздың көлемін ұлғайтуы және тағы басқа қолайлы қасиеттері болады. Біржасушалы және көпжасушалы ағзалар жасушаларының биохимиялық үдерістерінің барлығы сулы ортада өтеді. Су әр түрлі климаттық жағдайлардағы физиологиялық үдерістердің калыпты өтуіне себепкер болады. Ол сондай-ақ көптеген минералдық және ағзалық заттардың жақсы еруіне себепкер бола алады. Табиғи су құрамында сан алуан тұздың болатыны да сондықтан. Ағзалар жұғымды заттарды тек еріген түрінде сіңіреді.
2. Химиялық реакцияның жылу эффекті деген не? Өлшем бірлігі
Химиялық реакциялардың жылу эффекті
Химиялық реакциялар
Экзотермиялық реакция (жылу бөле жүретін)
+Q - жылу бөліну
Эндотермиялық реакция (жылу сіңіре жүретін)
- Q - жылу сіңірілу
Анықтамалар
«Экзо» - гректің «сыртқа» деген сөзі. Жылудың реакция жүріп жатқан ортадан, сыртқы қоршаған ортаға бөлініп шығатынын білдіреді.
«Эндо» - гректің «ішке» деген сөзі. Жылудың сырттағы қоршаған ортадан реакция жүріп жатқан ортаға берілетінін білдіреді.
Реакцияның жылу эффекті көрсетілген химиялық реакциялар термохимиялық теңдеулер
деп аталады.
3. 50 г 16%-тік сілті ерітіндісін дайындау үшін қанша грамм сілті алу керек?
Берілгені:
m(ерітінді) = 50 г
W(ерітінді) = 16%
Табу керек: m(сілті ерітіндісі) -?
Шешуі:
W(ерітінді)= m(сілті ерітіндісі)/ m(ерітінді)*100% → m=(m(ерітінді)* W(ерітінді)/ 100%
m(сілті ерітіндісі) = (50г*16%)/100% = 8г.
Жауабы: 8 г. сілті алу керек.
немесе есепті шығаруының 2-ші жолы:
50*16=800
800/100=8 грамм сілті алу керек!
№22 Билет
1. Табиғаттағы тірі организмдердегі және адам тіршілігіндегі химиялық реакциялардың биологиялық маңызы қандай? Мысал келтір.
Денедегі зат алмасу процесі қуат алмасуымен тығыз байланысты. Зат алмасу барысында қоректік заттардағы потенциалдық энергия босанып, ол механикалық, жылу, электр, сәуле энергияларына айналады да, ең соңыңда организмнен жылу түрінде бөлінеді. Демек, организмге энергия қоректік заттар құрамында келеді де, ол тіршілік әрекеттерін атқаруға, түрлі өнімдер өндіруге жұмсалады.
Өлі табиғаттағы энергия алмасуынан жасушаларда жүретін процес-тер үш түрлі принциппен ерекшеленеді
1) қоректік заттардың химиялық энергиясы жылу энергиясына айналмай-ақ бірден әртүрлі жұмыстар атқаруға пайдаланыла береді және энергияның басқа түріне ауыса алады. Демек, тірі организм хемодинамикалық принциппен жұмыс істеп, энергия көзін тиімді
пайдаланады.
2) тірі организмде энергия мысқалданып бөлінеді. Бұл организмді Энергиялық думпуден сақтап, қуатты толық пайдалануға мүмкіндік береді.
3) көмірсулар, белоктар, майлар ыдыраған кезде бөлінген энергияның артық мөлшері энергияның биологиялық аккумуляторы — мол қуатты заттардың (макроэрттердің) құрамына ену арқылы организмде жинақталып, қорда сақталады.
Жасушаларда энергия үшкарбон қышқылы айналымына қатысатын маңызды метаболиттердің түзіліп, тотығуы кезінде босанып, жинақталады. Бұл процесс үстінде сутегі молекуласы бөлініп, көмір қышқыл газы түзіледі. Босанған сутегі молекуласы дегидрогеназалар коферменттерінің (НАД, НАДФ, ФАД) көметімен тотығу тізбетіне немесе тыныстық тізбекке қосылады. Бұл тізбекте сутегі электрондары біртіндеп жоғары энергетикалық тізбектен төменгі энергетика-лық тізбекке өтеді де, ең соңғы акцепторға — оттегіне беріледі, басқаша айтқанда ол тотығады. Бұл процесс барысында бөлінген энергияның аздау бөлігі (30-40%) жылу түрінде болінеді де, қалған бөлігі (60-70%) АТФ-тың макроэргиялық байланыстарында жинақталады. АТФ-тың осылай тыныстык тізбектегі сутегінің тотығу энергиясының есебінен түзілу жолын тотықпалы фосфорлану деп атайды. Сонымен, энергия өзгерістерінің негізінде қоректік заттардан электрондар босанып шығуы салдарынан олардағы қуаттың организмдегі химиялық реакцияларды жаңдандыратын қасиеттері жатады.
Организмдегі энергая алмасуын энергия тендестігін анықтау арқылы зерттейді. Ол үшін организм қабылдаған және бөлген энергия мөлшерін салыстырады. Организмнің қорекпен қабылдаған энергиясының мөлшерін брутто (жалпы) энергия деп атайды. Брутто энергия мен организмнің зәрмен, нәжіспен, түрлі газдармен бөлген және қабылданған қорек пен ішкен суды жылытуға шығындаған энергиясының айырмасын нетто-энергия дейді. Демек, нетто-энергия организмнің тіршілік әрекеті үшін жұмсалатын энергия. Брутто-энергия мен нәжіс энергиясының айырмасын қорыту энергиясы дейді. Ал, қорыту энергиясы мен зәрмен бөлінген энергия айырмасын алмасу энергиясы деп атайды. Алмасу энергиясы организмнің тіршілік әрекеті мен өнім өндіруге (жұмыс атқаруға) жұмсалатын энергия.
Организм қабылдаған жалпы энергияны қоректік заттардың қуаттық құндылығына сүйене отырып анықтайды. Ал, қоректік заттардың қуаттық құндылығын анықтау үшін арнаулы аспап-калоримет-риялық құты (бомба) қолданылады. Бомбаның ішіне 1 г зерттелетін зат салынады да, оны таза оттегімен толтырып, электртогын қосып, жағады. Зерттелетін зат бөлген жылу мелшері Джоуль бірлігімен өлшенеді. Калориметриялық бомбада жанғанда 1 г көмірсу 17,6 кДж (4,1 ккал), 1 г белок — 24,3 кДж (5,7 ккал), 1 г май — 38,9 қДж (9,3 ккал) энергая бөледі. Организмде белок толық тотықпайды белок құрамынан бөлінген амин тобынан түзілген несепнөр өзімен бірге біршама энергияны ұстап қалады. Осымен байланысты белоктар организмде 17,6 кДж (4,1 ккал) ғана энергия бөледі.
Рацион құрамыңдағы көмірсулар, белоктар және майлар мөлшерін анықтағаннан соң, организм қабылдаған энергия мөлшерін есептеп шығаруға болады, Калориметриялық бомба көмегімен зәрдің, нәжістің кұрамындағы энергияны есептеп шығаруға болады.
Газдардың калориялық коэффициенті организмде тотыққан орга-никалық заттардың табиғатына байланысты өзгеріп отырады. Мысалы, белок тотыққанда организм сіңірген оттегінің, әр литріне 4,8 ккал энергия, май тотыққанда — 4,7 ккал, ал көмірсулар тотыққанда -5,05 ккал энергия бөлінеді. Демек, организм шығындаған энергияны анықтау үшін денеде тотыққан запъщ табиғатын білу керек. Ал, оны тыныс коэффиц
 2015-06-04
2015-06-04 6124
6124