ХХ ғасырдың басында атомның да күрделі бөлшек екені, оның өзінен де кіші бірнеше бөлшектерге бөлінетіні белгілі болды. Бірнеше атомдардың өзара байланысуынан молекула түзіледі.
Атом дегеніміз - химиялық жолмен бөлінбейтін затттың ең ұсақ бөлшегі;
Молекула дегеніміз - заттың қасиеттерін бойына жинаған оның ең кіші бөлшегі;
Айырмашылы: атом ең кішісі, молекула атомнан үлкені; Атомда белгілі бір қасиеттер болмайды, ал молекулада заттың химиялық, физикалық қасиеттері жиналады;
Атомдар мен молекулалардың кристалдағы орналасу ретін, олардың жалпы сұлбасын қазіргі электрондық микроскоптар мен иондық проекторларда көруге болады.
Жекелеген атомдар-химиялық элементтердің, ал молекулалар заттардың ең кіші бөлшектері.
Әр түрлі заттардан денелер құралады.
2. Тотығу тотықсыздану реакциялары мысалдар 144 бет
Тотығу-тотықсыздану - электрондардың бір атомнан екінші атомға жаппай немесе жартылай ауысуына негізделген химиялық әрекеттесу үлгілерінің үлкен тобы. Тотығу дегеніміз— атомның немесе атомдар тобының өз электрондарын беруі нәтижесінде өз валенттілігін өсіруімен сипатталатын химиялық әрекет; тотықсыздану — атомдардың немесе иондардың электрондарды өзіне қосып алуы, сөйтіп өз валенттілігін төмендету. Органикалық заттар химиясында тотығу әрекет өрекетінің мысалы ретінде заттың оттегін өзіне қосып алуы ал, тотықсыздану әрекетінің мысалы ретінде заттың сутекпен әрекеттесуі алынады.
Валенттілік электрондары электртерістілігі кіші атомдардан электр терістілігі үлкен атомдарға ауысатын немесе ығысатын процестер тотығу-тотықсыздану реакциялары деп аталады.
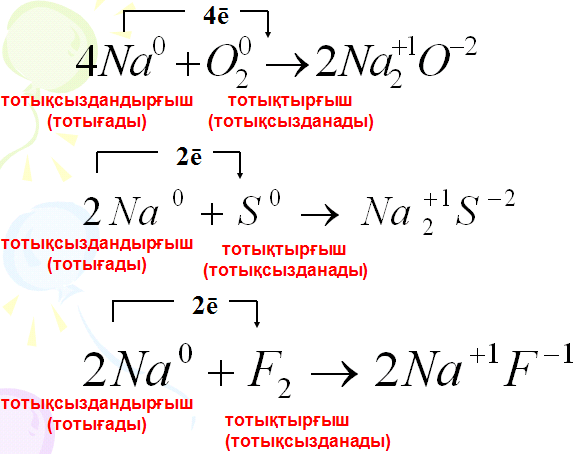
3. Құрамында 32г мыс болса, Сu2O массасы қандай?
Шешуі:
Мыстың молярлық массасы 64г/моль, демек 1 моль Сu2O (купритте) 128 грамм мыс бар. 32 г мыс болу үшін 0,25 моль куприт алу қажет.
M(Cu2О) =64*2+16=128+16=144 г/моль куприт массасы = 144*0,25=36 грамм
жауабы - 36 грамм
Немесе есепті шешудің 2-ші жолы:
В М (Сu2О) содержится 2А (Си)
В Х (г) (Сu2О) содержится 32 (г) Си
Х=144*32:64:2=36 грамм
№5 Билет
1. Химиялық элементтер, олардың таңбалары және атауы. Оны кім шығарды?
Химияның негізгі түсініктерінің бірі — элемент. Элемент дегеніміз атомдардың жеке түрі. Бұл түсінікті химия ғылымына ағылшын ғалымы Р. Бойль енгізген. Қазіргі кезде химиялық элементтердің 108 түрі белгілі, олардың ішінде 89-ы табиғатта кездессе, қалған 19-ы жасанды жолмен алынған.

Химиялык әдебиетте элементтерді өздеріне тән таңбалармен белгілеу қабылданған, Бұл дәстүрді швед ғалымы Й.Я. Берцелиус ұсынған. Элементтердің таңбалары олардың латынша атауларының бірінші және келесі әріптердің бірімен белгіленеді. Мысалы, сутек - Hydrogenium (Н), оттек - Oxygenium (0), темір - Ferrum (Fе), мыс - Cuprum (Cu), сынап - Hydrargyrum (Hg), күкірт - Culfurum (S) т.б. Элемент таңбасының алдында тұрған сан коэффициент деп аталады, ол атомдар санын көрсетеді (5Fе, ЗН).
Жай заттардың молекулалары бірдей атомдардан тұрады, мысалы, Fе,Cu; ал газ тектес жай заттардың молекулалары бірнеше атомнан тұрады, олардың сандары индекспен көрсетіледі, мысалы, 09, Н2. Индекс элемент таңбасының оң жағына астына жазылады.Кейбір жай заттардың атаулары оларды құрайтын элементтің атауымен сәйкес келеді, мысалы, күкірт - S, азот - N2, оттегі - 02, темір - Fе, мыс -Cu, т.б.
Судың құрамында оттек элемент күйінде болса, ауаның құрамында жай зат күйінде болады, сондықтан ауадағы оттегімен тыныс алуға болады және ол жануды колдайды, ал судағы оттек Бұл мақсаттарға пайдаланылмайды.
Сутегі (Н2) жанады, ол жай зат; ал судың Н20 құрамындағы сутек (Н) жанбайды, ол элемент.
Атомдар мен молекулалар өте кішкентай бөлшектер, сондықтан оларды көзбен көріп, қолға алуға болмайды.
Металдарға ортақ кейбір қасиеттері: металдык жылтыры, электр және жылу өткізгіштігі, оңай соғылып тапталатындығы, т.б. Ал бейметалдардың ортақ қасиеттері болмайды.
2. Экзотермиялық және эндотермиялық реакциялар дегеніміз не?
Кез келген химиялық реакцияларда бір зат басқа затқа айналғанда жылу бөлінеді немесе сіңіріледі. Сондықтан барлық реакцияларды экзотермиялық және эндотермиялық деп бөледі. Яғни, экзотермиялық реакция дегеніміз - жылу бөле жүретін реакция, ал эндотермиялық реакция дегеніміз - жылу сіңіре жүретін реакциялар. Бұл реакциялар термохимиялық теңдеулермен өрнектеледі. Термохимиялық теңдеулердің басты ерекшелігі, оларда жылу эффектісінің шамасы көрсетіледі.
Реакция жылу эффектісіне қарай:
1. Экзотермиялық - жылу бөле жүретін реакциялар. мысалы, C+O2=CO2+Q
2. Эндотермиялық - жылу сіңіре жүретін реакциялар. Мысалы, CaCO3=CaO+CO2-Q
3. 1.5 моль натрий сульфаты Na2SO4 берілген. Осы тұздың массасын тап.
Шешуі: Зат мөлшерінің массамен байланысты формуласы арқылы V=m/M зат массасын табамыз:m=v*M сан мәндерін орнына қойсақ: M (Na2SO4)= 142 г/моль.
m= (Na2SO4)=1.5 моль *142 г/моль=213 г.
Жауабы: 1.5 моль натрий сульфатының массасы 213г
Немесе есепті шешудің 2-ші жолы:
M(Na2SO4)=142
m=n*M=1,5*142=213
№6 Билет
1. Жай және күделі заттар. Салыстырмалы атомдық масса. Салыстырмалы молекулалық масса анықтама және мысал келтір
Элементтердің таңбалары әліпбидін, әріптері тәрізді. Әріптерден сөз құрауға болатыны секілді элементтердің таңбаларын қолданып кез келген молекуланың құрамын өрнектеуге болады. Химиялық формулалар заттың сапалық және сандық құрамын көрсетеді, сандық құрамы индекстер аркылы белгіленеді (бір саны жазылмайды). Жай заттар үшін элементтің таңбасы - формуласы да болады: Ғе, Cu, Ag, Ar.
Мысалы, Н20 (аш екі о) судың формуласы, су молекуласы сутек пен оттек элементтерінен (сапалык құрамы) және сутектің екі атомы мен оттектің бір атомынан (сандық құрамы) тұратынын көрсетеді.
Формуланың алдындағы коэффициенттер молекулалар санын көрсетеді. Мысалы, 5S02(бес эс о екі), Р20. (рэ екі о бес), т.б.
1. Формулалар бойынша зат күрделі немесе жай зат екенін анықтай аламыз:02 - жай зат; Н20 - күрделі зат.
2. Молекула құрамына кіретін элемент атомдарының сандарының ара қатынасын анықтауға болады. NaOH - Бұл қосылыста атомдар сандарының қатынасы 1:1:1 болады, ал CuS04 молекуласында бұл қатынас - 1:1:4
3. Заттың формуласы бойынша оның молекулалык массасын аныктауға болады.
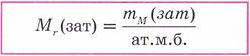
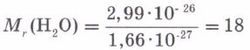

Салыстырмалы молекулалық масса деп зат молекуласы массасының атомдық масса бірлігінен неше есе ауыр екенін көрсететін шаманы айтады, ол МR деп белгіленеді.
Бұл шама молекуланың абсолюттік массасы деп аталады. Зат молекуласы атомдардан тұратындықтан, оның салыстырмалы молекулалық массасын табу үшін зат құрамына кіретін элементтердің салыстырмалы атомдық массаларын (АR) индекстеріне көбейтіп қосамыз.
Мысалы, CuS04 молекуласының салыстырмалы молекулалық массасы:
Mr(CuS04)=Ar(Cu)+Ar(S)+4Ar(0) Mr(CuS04)=64+32+4 • 16=160
Енді осы заттың бір молекуласының массасын табу үшін формуланы пайдаланамыз.
mM(CuS04) = 160 • 1,66 • 10−27 = 2,66 • 10-25 кг.
2. Негіздер: құрамы, жіктелуі, химиялық қасиеттері, алынуы. 119 бет
Негіздер – ерітінділерінде бір немесе бірнеше гидроксид иондарын түзіп, диссоциацияланатын күрделі заттар. Егер элемент бірнеше гидроксид түзетін болса, оның тотығу дәрежесі рим цифрымен көрсетіледі. Мысалы, Cu(OH)2 – мыс (ІІ) гидроксиді, CuOH – мыс (І) гидроксиді. Негіздердің көпшілігі суда ерімейді немесе аз ериді. Суда жақсы еритін Негіздерді сілтілер деп атайды. Оларға LіOH, NaOH, KOH, RbOH, CsOH, Sr(OH)2, Ca(OH)2, Ba(OH)2, NH4OH (NH3*H2O аммиак суы) жатады. Сілтілердің судағы ерітінділері теріні, матаны, т.б. күйдіреді. Осыған байланысты кейде оларды күйдіргіш калий, күйдіргіш натр, т.б. деп те атайды. Құрамында екі не үш гидроксид тобы бар Негіздер ерітіндіде сатыланып диссоциацияланады. Мысалы, Ca(OH)2*Ca(OH)++OH (бірінші саты), Ca(OH)+Ca2++OH– (екінші саты). Сонымен қатар бір мезгілде қышқылдық және негіздік типпен диссоциациялана алатын Негіздер (гидроксидтер) де болады. Негіздердің маңызды химиялық қасиеттері олардың қышқылдармен, қышқылдық және амфотерлік оксидтермен немесе гидроксидтермен тұз түзе әрекеттесуі. Сілтілік металдар гидроксидтері қыздыруға төзімді. Суда жақсы еритін Негіздерді негіздік оксидтерін сумен тікелей әрекеттестіру арқылы алады. Мысалы, CaO+H2O*Ca(OH)2. Суда аз еритін немесе ерімейтін Негіздерді сәйкес элементтің тұзына ерімтал гидроксидтермен әсер ету арқылы жанама жолмен алады. Мысалы, FeCl3+ +3NaOH Fe(OH)3+ 3NaCl.
3. Массасы 10г неон газында қанша атом болатынын табыңдар
Берілгені: m (Nе) = 10 г
Шешуі:
n(зат саны) = 10/20=0,5 моль
n (Nе) = 0,5 * 6,02 * 1023 = 3,01 * 1023
№7 Билет
1. Химиялық формула. Химиялық элементтердің валенттілігі дегеніміз не және валенттілік термині нені білдіреді? 35 бет.
Химиялық формула — химиялық жеке заттар молекуласының құрамын химиялық таңба және сан арқылы белгілеу. Химиялық формула молекуланың сапалық және салмақ құрамын көрсетеді. Мысалы, жай зат күйіндегі оттек молекуласының химиялық формуласы — О2, күрделі зат аммиактың химиялық формуласы — NH3. Бұл химиялық формулада оттек молекуласында екі атом оттек, яғни оның 32 салмақ бөлігі бар екендігін, ал екіншісінің бір молекуласының құрамында бір атом азот және үш атом сутек, яғни олардың өзара қатынасы 14:3, жалпы салмағы 17 салмақ бөлігі екендігін көрсетеді. Химиялық формула бойынша химиялық қосылыстар құрамындағы элементтердің пайыздық мөлшерін есептеуге болады, керісінше, химиялық қосылыстар құрамындағы элементтердің пайыздық мөлшері белгілі болса, олардың формулаларын табуға болады. Cr2O3-тегі (хром тотығы) элементтердің пайыздық мөлшерін есептегенде, оның м16:152=31,6%. Хром тотығының пайыздық құрамы бойынша оның химиялық формуласы табылады. Ол үшін қосылыс құрамындағы элементтердің берілген салмақ қатынасын грамм-атом қатынасына айналдырады. 68,4 г хром 68,4:52=1,32 г-атом, 31,6 г оттек 31,6:16=1,98 г-атом болады. Кез келген молекуладағы×52:152=68,4%. Оттектің %-дық мөлш.: 3×16=152. Хромның %-дық мөлшері 2×52+3×олекулалық салмағы 2 атомдар қатынасы бүтін сан болуы керек. Мысалы, 1,32:1,98 қатынасын ең кіші бүтін сан қатынасына келтірсек 2:3 болады, бұған сай хром тотығының формуласы Cr2O3. Молекула құрамындағы атомдар қатынасы ең кіші бүтін санмен берілген формуланы қарапайым немесе эмпирикалық формула деп атайды. Молекула құрамында әрбір элементтен неше атом бар екенін дәл көрсететін формуланы нақты немесе молекулалық формула деп атайды. Химиялық қосылыстың нақты формуласын табу үшін, оның салмақ құрамын білумен қатар тәжірибе арқылы анықталған молекулалық салмағын да білу қажет. Сондай-ақ химиялық формуланываленттілік бойынша да құрастыруға болады.
Валенттілік, іліктілік (лат. valentіa — күш) — атомның басқа атомдарды немесе атомдар тобын қосып алып химиялық байланыс құру қасиеті. Валенттіліктің мәні берілген элементтің атомы ала алатын немесе орнын баса алатын сутек атомдарының санымен өлшенеді. Химияға валенттілік ұғымын 1853 ж. ағылшын химигі Э.Франкленд (1825 — 1899) енгізген. А.М. Бутлеровтың қосылыстардың химиялық құрылысы теориясына (1861) Валенттілік негіз болды, Д.И. Менделеевтің химиялық элементтердің периодтық жүйесін ашуына (1869) байланысты бұл ұғым одан әрі дамыды. Менделеев элементтің валенттілікінің оның периодтық жүйедегі орнымен байланыстылығын тапты, айнымалы валенттілік туралы ұғымды енгізді, элементтің сутекпен және оттекпен қосылыстарындағы валенттіліктерінің өзара байланысын көрсетті.
Валенттілік рим цифрларымен белгіленеді, формулаларда элемент таңбасының үстіне жазылады, мәні I-VIII-гe дейін өзгереді. Валенттілік бойынша формула құру үшін элементтердің валенттіліктерінің ең кіші ортак еселігін тауып, әр элементтін валенттілігіне бөліп, индекс етіп жазамыз. Егер элемент қосылыстарында айнымалы валенттілік көрсетсе, онын, атауында элементтің валенттілігі рим цифрымен жақшаның ішінде көрсетіледі.
2. Қышқылдар: құрамы, жіктелуі, химиялық қасиеттері, алынуы.Мысал келтір 87, 90, 122 бет
Қышқыл — химиялық қосынды, көк лакмус қағазына қызғылт рең беретін ерітінді, дәмі қышқыл. Қышқылдарқұрамына қарай оттекті, оттексіз болып, олардағы сутек атомдарының сандарына қарай бір және көп негізді деп бөлінеді.
Азот, тұз, күкірт қышқылдары сұйық заттар, ал фосфор және бор қышқылы (Н3BО3) - қатты заттар болса, кремний қышқылы суда ерімейтін іркілдек зат. Көмір және күкіртті қышқылдары тұрақсыз, оңай айырылатын заттар.
H2CO3→CO2↑+H2O;
H2SO3→H2O|+SO2↑
Қышқылдардың құрылысының формуласын жазғанда әуелі сутектің таңбасын шетіне жазамыз, өйткені ол бір валентті элемент.
Кейбір қышқылдардың тарихи қалыптасқан атаулары бар: HCl - тұз қышқылы, HF -балқытқыш қышқыл; Н2РO4 - сутектің ортофосфаты, ал Н2СO3 - сутектің карбонаты деп аталады.
Ал халықаралық номенклатура бойынша Н2РO4 тетраоксотригидрофосфат деп молекула құрамындағы атомдардыңсандары грек сандарымен көрсетіліп аталады. Қышқылдарға сәйкес келетін оксидтерді қышқылдардың ангидридтері (сусыз қышқыл) деп атайды.
Оттексіз қышқылдарды жай заттардың тікелей әрекеттесуі (синтез әдісі) бойынша алады:
H2+Cl2=2HCl
H2+S=H2S
Түзілген газдарды суда еріткенде қышқылдар алынады.
Кейбір оттекті қышқылдарды сәйкес оксидтерін сумен әрекеттестіріп алады:
SО2+H2О=H2SО3
SО3+H2О=H2SО4
Егер фосфорды жағып алып, түзілген ақ буға су қосып шайқасақ, ерітінді лакмусты қызғылт түске бояйды, себебі мына реакциялар жүреді:
4P+5O2=2P2O5
P2O5+3H2O=2H3PO4
қышқылдық оксид + су = қышқыл
Кейбір ұшқыш, тұрақсыз және ерімейтін қышқылдарды олардың тұздарына концентрлі қышқылмен әсер етіп алуға болады.
Ас тұзының кристалдарына концентрлі күкірт қышқылын қосқанда хлорлы сутектің ақ тұманы газ күйінде бөлінеді, оны суда ерітіп тұз қышқылын аламыз.
NaCl+H2SO4=2HCl↑+Na2SO4
Осы реакцияны кеңсе желіміне концентрлі тұз қышқылымен әсер етіп көрсетеміз.
Na2SiО3+ 2HCl = H2SiO3↓ + 2NaCl
Қышқылдардың химиялық қасиеттері
Қышқылдардың қасиеттері алуан түрлі болып келеді, оны көрсету үшін мынадай сұлба жазып аламыз:
Қышқылдар:
1. белсенді металдармен
2. негіздік оксидтермен
3. негіздермен
4. тұздармен
5. қыздырудың әсері (кейбір қышқылдар үшін)
3. Массасы 22г көмірқышқыл газының зат мөлшерін есепте.
Жауабы: 11,2 л
№8 Билет
1. Физикалық және химиялық құбылыстар дегеніміз не және айырмашылығы Химиялық реакциялар. Мысалдар
Ағаштан орындық үстел, төсек, т.б. үй жиһаздары жасалады. Бұл мысалда бір заттан әр түрлі денелер дайындалатынын көреміз. Заттардың өзара ұқсастығы мен айырмашылықтарын көрсететін белгілері олардың қасиеттері деп аталады. Оларға заттың агрегаттық күйі, түрі, түсі, тығыздығы, балқу және қайнау температуралары, жылу және электрөткізгіштктері, ерігіштіктері жатады. Мысалы, шыныдан, пластмассадан жасалған шөлмектер алып, оларды ұрып көрсек, шыны шөлмек оңай сынатынын, ал қыздырғанда пластмасса шөлмек оңай балқып, олардың пішіндерінің өзгеретінін байқаймыз. Мұндай өзгерістер физикалық құбылыстар деп аталады.
Ал енді осы шөлмектерді жағып көрсек, ең оңай өзгеретіні - пластмасса шөлмек, ол алдымен балқып, сосын қара күйеленіп жанады, ал шыны мен металдан жасалғандары Мұндай езгеріске түсу үшін оларды өте жоғары температураға дейін қыздыру керек. Бір заттың екінші бір затқа айналуы химиялық құбылысқа жатады, мысалы, сүт тасып кеткенде ол күйіп, көмірленеді. Пластмасса жанғанда басқа заттар тұзіледі.
Физикалық құбылыс кезінде заттардың табиғаты өзгермейді, тек олардың агрегаттык күйі мен пішіні өзгереді, жаңа зат пайда болмайды. Химиялық құбылыс кезінде бір зат басқа жаңа бір затқа айналады.
Заттардың химиялық қасиеттерін химия ғылымы зерттейді.
Осы кезде сан алуан заттар белгілі, олардың саны күн өткен сайын артып отыр, себебі тұрмыстық және өндірістік кажеттіліктерді қанағаттандыру үшін қасиеттері әр түрлі заттар жасанды жолмен алынуда.
Заттардың қасиеттерін жете білу оларды саналы түрде колдана алуға мүмкіндік береді. «Білмеген у ішеді» деген мақалда халықтың көп жылғы бақылауынан түйген даналық ой айтылған. Шынында да қасиетін білмей тұрып кез келген затты иіскеп, колға алып уқалап немесе дәмін татып көруге болмайды: себебі күйіп, тіпті уланып қалу қаупі бар.
Химияның атқаратын көптеген маңызды міндеттері бар.
1. Заттардың құрамы мен қасиеттерін зерттеу.
2. Қоғамның кажеттілігіне карай жаңа сапалы заттар алу.
3. Қоршаған ортаның байлығын тиімді пайдаланып, оларды корғау.
Біздің киген киіміміз, ішкен асымыз, тұтынып отырған заттарымыз — бәрі де химиялық қосылыстар. Тіпті біздің өмір сүруіміздің өзі ағзаларда жүретін химиялық құбылыстарға негізделген
2. Оксидтер: алынуы, жіктелуі, химиялық қасиеттері. 114-116 бет.
Күрделі қосылыстардың үлкен бір тобы (класы) - оксидтер. Оксидтер үшке бөлінеді: қышқылдық, негіздік, екідайлы (амфотерлі).
Қышқылдық оксидтерге - қышқылдар, негіздік оксидтерге - негіздер сәйкес келеді. Р2О5→Н3РО4; SО3→H2SО4; Na2О→NaОH; СаО→Са(ОН)2. Ал екідайлы оксидтерге кышқылдар да, негіздер де сәйкес келеді, мысалы, H2ZnО2← ZnO→Zn(OH)2
Оксидтердің жіктелуі. Бейметалдардың оксидтері - қышқылдық оксидтер, ал белсенді металдардың оксидтері - негіздік болып келеді.
Егер металл айнымалы валенттілік көрсетсе, оның төменгі валенттілігіне сәйкес оксиді - негіздік, аралық валенттілігіне сәйкесі - екідайлы, ал жоғары валенттілігіне сәйкесі қышқылдық оксид болады.
Кейбір оксидтер үшін қарапайым (үйреншікті) атаулары бар, олар ертеден қолданылып келеді. АІ2О3 - глинозем, SiО2- кремнезем.
Оксидтердің алынуының екі үлкен тәсілі бар.
Жай және күрделі заттарды жағу арқылы:
бейметалдарды:
C+O2=CO2
S+O2=SO2
металдарды:
2Cu+O2=CuO
2Mg+O2=MgO
күрделі заттарды:
CH4+2O2=CO2+2H2O
2H2S+3O2=2H2O+2SO2
Ерімейтін негіздер, тұздар, қышқылдарды айыру аркылы:
2Fe(OH)3→Fe2O3+3H2O
CaCO3→CaO+CO2
H2SiO3→H2O+SiO2
Оксидтерді әрі карай тотыктыру аркылы:
2SO2+O2=2SO3
4FeO+O2=2Fe2O3
Оксидтердің физикалық қасиеттері[өңдеу]
Оксидтер үш агрегаттық күйде болады: мысалы,
CuO, CaO, Fe2O3, P2O5 - қатты заттар;
CO2, SO2, NO2 - газдар;
H2O, N2O3(t<0) - сұйық.
Оксидтердің түстері де әр түрлі: Ғе2О3 - қызыл-қоңыр, CuO - кара, Сr2O3 - жасыл, ZnO, MgO - ақ, МnO2 - кою қоңыр, SnO - кою көк түсті, т.б.
Иістері де әр алуан түрлі болып келеді. SО2, SО3, NО2, Р2О5 - тұншықтырғыш иісті. CO, NO, СО2 - иіссіз.
Оксидтердің химиялық қасиеттері[өңдеу]
Оксидтердің қасиеттері олардың, қандай элементтердің оксидтері екендігімен анықталады.
Қышқылдық оксидтердің қасиеттері
Кейбір қышқылдық оксидтер сумен әрекеттесіп қышқылдар түзеді:
Р2O5+ЗН2O=2Н3РO4;
SO2+H2O=H2SO3;
СO2+Н2O=Н2СO3
Мысалы, күлгін лакмус ерітіндісі тамызылған суға көмірқышқыл газын жіберсек, оның түсі күлгіннен біртіндеп қызыл түске өзгереді. Нәтижесінде әлсіз, тұрақсыз көмір қышқылы түзіледі.
қышқылдық оксид + су = қышқыл
Қышкылдық оксидтер негіздік оксидтермен әрекеттесіп тұз түзеді
CO2+CaO=CaCO3
P2O5=2Na3PO4
қышқылдық оксид + негіздік оксид = тұз
Қышқылдық оксидтер сілтілермен әрекеттесіп тұз және су береді
SO3+2NaOH=Na2+H2O
Cr3+Ca(OH)2=CaCrO4+H2O
қышқылдық оксид + сілті = тұз + су
Негіздік оксидтердің қасиеттері
Белсенді металдардың оксидтері сумен әрекеттесіп сілті түзеді
Na2O+H2O=2NaOH
CaO+H2O=Ca(OH)2
Осы реакциялардың ішінен екіншісін тәжірибе жасап көрсек, яғни сөндірілмеген әкке су құйып, үстіне бір тамшы фенолфталеин тамызсақ, оның түсі таңкурай түске өзгереді, ол әрине сілтінің ерітіндісі түзілгендігіне дәлел болады.
белсенді металл оксиді + су = сілті
Негіздік оксидтер қышқылдармен әрекеттесіп тұз және су түзеді
CaO+2HCl=CaCl2+H2O
CuO+H2SO4+H2O
негіздік оксид + қышқыл = тұз + су
Екідайлы оксидтердің қасиеттері
Олар негізінен қатты күйде кездеседі.
1) Қышқылдармен әрекеттескенде негіздік оксидтің қасиетін көрсетеді:
ZnO+2HCl=ZnCl2+Н2O
2) Сілтілермен әрекеттескенде қышқылдық оксидтің қасиетін көрсетеді. Түзілген тұздың формуласын жазу үшін оксид формуласына ойша бір молекула су қосып, сәйкес қышқылдың формуласын шығарып аламыз. (ZnО+H2О=H2ZnО) әрі қарай қышқыл мен негіз әрекеттескен сияқты болады. Олардың қолданылу аясы өте кең:
ZnО+2NaОH=Na2ZnО2+H2О
cy + тұз = сілті + екідайлы оксид
3. Массасы 4г күкірт жаққанда, 37,1 кДж жылу бөлінді. Күкірт (IV) оксидінің түзілу реакциясының термохимиялық теңдеуін құраңдар.
Шешуі:
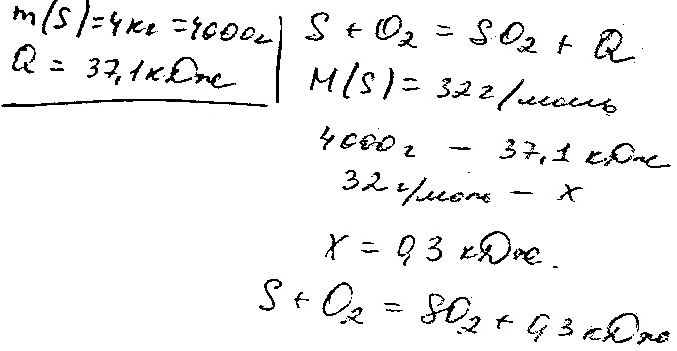
№9 Билет
1. Химиялық реакциялардың типтерінің жіктелуі. Мысалдар келтір.
Қосылу реакциясы
Қосылу реакциясы нәтижесінде бірнеше (жай немесе күрделі) заттардан бір күрделі зат түзіледі.
А+В->С
A+B+C->D
Мысалы:
Ғе + S= FeS
жай + жай = күрделі зат
СаО + Н20 = Са(ОН)2
күрделі + күрделі = күрделі зат
СаС03+С02+Н20=Са(НС03)2
күрделі заттар = күрделі зат
2SOa + 02 = 2S03
күрделі + жай = күрделі
 2015-06-04
2015-06-04 7750
7750








