Наиболее древнее происхождение имеет, вероятно, протонная АТФаза. Она обнаружена в клетках всех организмов, в том числе и у первичных анаэробов-бродильщиков, синтезирующих АТФ в реакциях субстратного фосфорилирования. Гипотетические первичные клетки получали всю энергию за счет субстратного фосфорилирования и имели слаборазвитые биосинтетические способности. Поступление необходимых органических соединений из внешней среды и выделение конечных продуктов брожения происходило по механизму пассивного унипорта (см. рис. 26). Первичные клетки, вероятно, не имели клеточной стенки, а были отграничены от окружающей срезы только элементарной мембраной. Очевидно, что активные транспортные процессы, обеспечивающие избирательный перенос веществ против их концентрационных градиентов, были необходимы на очень ранних этапах клеточной эволюции.
Для выполнения этой задачи в клетках и была сформирована локализованная в ЦПМ АТФ-зависимая протонная помпа. Энергия гидролиза АТФ, осуществляемого АТФазой, использовалась для выталкивания протонов из клетки во внешнюю среду. Гидролиз одной молекулы АТФ приводит к переносу 2 протонов и созданию таким путем трансмембранного электрохимического протонного градиента. Экспериментально это было показано для молочнокислых бактерий и клостридиев, у которых нет дыхания, но в ЦПМ локализованы АТФазы, расщепляющие молекулы АТФ, образующиеся при брожении.
Таким образом, использование АТФ для создания H+ на мембране — эволюционно очень древний механизм прокариотной клетки. Позднее возник механизм синтеза АТФ за счет H+. Для этого надо было изменить направление работы протонного АТФазного комплекса.
|
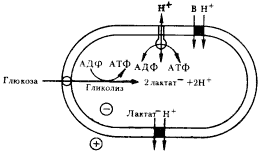
| Рис. 90. Схема энергетических и транспортных процессов у молочнокислых бактерий. Темный кружок — переносчик; В — молекула растворенного вещества; глюкоза поступает в клетку с помощью фосфотрансферазной системы. Остальные объяснения см. в тексте |
Обратимо функционирующие протонные АТФазы мы находим у первичных анаэробов, получающих энергию в процессе брожения. Обнаружено, что выделение во внешнюю среду молочной и уксусной кислот молочнокислыми бактериями и клостридиями приводит к созданию на ЦПМ протонного градиента. У стрептококков, осуществляющих гомоферментативное молочнокислое брожение, молочная кислота накапливается в клетке в виде аниона, для которого ЦПМ практически непроницаема. Выход лактата из клетки происходит в процессе Электронейтрального симпорта с протонами (рис. 90). Аналогичную картину наблюдают у Clostridium pasteurianum, у которого накапливающиеся в клетке ионы ацетата проходят через ЦПМ в недиссоциированной форме. Поскольку внутри клетки концентрации молочной и уксусной кислот в начале брожения всегда выше, чем во внешней среде, выход их осуществляется с помощью соответствующих переносчиков по концентрационному градиенту, т. е. в процессе облегченной диффузии, не требующей энергетических затрат. Транспорт H+ в симпорте с лактатом или ацетатом приводит к генерированию на ЦПМH+. При накоплении во внешней среде кислот их концентрационный градиент постепенно падает, в результате чего способность образовывать протонный градиент, связанный с выделением кислот из клетки, уменьшается. При высоких концентрациях молочной и уксусной кислот в среде образование H+ на мембране зависит только от гидролиза АТФ.
Электрохимическая энергия протонного градиента, возникающая при выделении из клетки кислот в процессе брожения, может использоваться для транспорта в нее растворимых веществ, а также для синтеза АТФ, который осуществляется при функционировании протонной АТФазы в обратном направлении, т. е. в АТФ-синтазной реакции. Выход энергии за счет выделения из клетки продуктов брожения может быть довольно значительным. При гомоферментативном молочнокислом брожении, по проведенным подсчетам, он может достигать 30% от общего количества энергии, вырабатываемой клеткой. Таким образом, у некоторых эубактерий, получающих энергию в процессе брожения, АТФ может синтезироваться в реакциях субстратного фосфорилирования и дополнительно за счет использования H+, образующегося при выходе конечных продуктов брожения в симпорте с протонами. Следовательно, эубактерий с облигатно бродильным типом энергетики уже имеют протонные АТФазы, функционирующие в направлении гидролиза и синтеза АТФ, т. е. катализирующие обратимое взаимопревращение двух видов метаболической энергии:
АТФ H+
Наконец, у некоторых первично анаэробных эубактерий-бродильщиков обнаружена АТФ-синтазная активность, сопряженная с короткими фрагментами переноса электронов с помощью связанных с мембраной переносчиков (см. ниже).
Растворимые системы переноса электронов на O2 у первичных анаэробов
Как известно, перенос электронов лежит в основе всех окислительно-восстановительных процессов. В разных видах брожений, рассмотренных в гл. 13, перенос электронов (водорода) от одних органических молекул к другим обычно осуществляют растворимые НАД-зависимые дегидрогеназы:
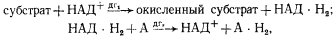
где дг — соответствующие дегидрогеназы, содержащие НАД в качестве кофермента; А — молекула органического вещества, служащая акцептором электронов. Молекулы НАД-H2 используются в конструктивном метаболизме, обеспечивая восстановитель для биосинтетических процессов, а также в системе энергетического метаболизма, участвуя в решении "акцепторной проблемы". Электронный перенос в этом случае не приводит к получению клеткой энергии, она вырабатывается только в реакциях субстратного фосфорилирования.
У некоторых эубактерий описан прямой перенос электронов с растворимых НАД-зависимых ферментов на O2, приводящий к его восстановлению:
НАД-H2 + O2 НАД+ + H2O2
Окисление НАД-зависимых дегидрогеназ осуществляется также через посредство флавопротеинов, катализирующих перенос 1, 2 или 4 электронов на O2, что приводит к образованию супероксидного аниона, перекиси водорода или воды соответственно. O2 и H2O2 далее могут разлагаться ферментами, разобранными выше в этой главе.
У аэротолерантных анаэробов, таких как молочнокислые бактерии и некоторые клостридии, флавопротеины выполняют роль основного связующего звена между субстратом и молекулярным кислородом. Подобные системы могут быть полезными, например, для создания анаэробных условий в результате поглощения O2 из среды, но не имеют отношения к получению клеткой энергии. Восстановление O2, при котором в роли оксидаз, т. е. ферментов, непосредственно осуществляющих перенос электронов на молекулярный кислород, выступают флавопротеины, получило название "флавинового дыхания". В основном при флавиновом дыхании осуществляется двухэлектронный перенос на O2. Так, у молочнокислых бактерий рода Streptococcus 90% поглощенного O2 восстанавливается до H2O2.
Наконец, у некоторых эубактерий обнаружены оксидазы флавопротеиновой природы, катализирующие прямое окисление субстратов, например пировиноградной и молочной кислот, молекулярным кислородом:
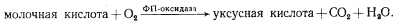
Общая черта перечисленных выше путей электронного транспорта с участием одного-двух посредников на O2 — протекание реакций в цитозоле клетки, т. е. вне связи с клеточными мембранами, и отсутствие при этом запасания клеткой полезной энергии.
Принципиально важным шагом на пути создания электрон-транспортных систем, приводящим к получению клеткой энергии, явилось встраивание электронных переносчиков в мембрану.
 2015-06-16
2015-06-16 730
730








