СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
DHof, кДж/моль -110,5 0 -74,85 -241,84
n, моль 1 3 1 1
Рассчитаем тепловой эффект получения 1 моля СН4:
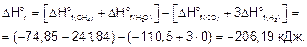
Находим количество вещества СН4, содержащееся в 67,2 л метана при нормальных условиях:
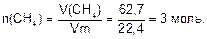
Согласно уравнению реакции при получении 1 моля СН4 выделяется 206,19 кДж теплоты, а при получении 3 молей метана
DHof = -206,19•3 = -618,57 кДж.
Ответ. При получении 67,2 л метана выделяется 618,57 кДж теплоты.
Пример 5. Вычислите стандартную энтальпию образования серной кислоты по следующим термохимическим уравнениям:
а) 2Н2О(ж) + 2SO2(г) + О2(г) = 2Н2SO4(ж), DHo1=-462 кДж;
б) 2Н2(г) + О2(г) = 2Н2О(ж), DHo2=-572 кДж;
в) S(к) + О2(г) = SO2(г), DHo3=-297 кДж.
Решение. Образование 1 моля серной кислоты H2SO4 из простых веществ S, O2 и Н2 происходит по реакции:
Н2(г) + S(к) + 2O2(г) = H2SO4(ж).
Чтобы получить это уравнение из данных термомеханических уравнений, надо в соответствии с первым следствием из закона Гесса провести с ними необходимые алгебраические действия: к сумме уравнений (а) и (б) прибавить уравнение (в), умноженное на 2, и разделить на 2, т.е. [(а)+(б)+(в)•2]/2.
 2Н2О(ж) + 2SO2(г) + О2(г) + 2Н2(г) + О2(г) + 2S(к) + 2О2(г) =
2Н2О(ж) + 2SO2(г) + О2(г) + 2Н2(г) + О2(г) + 2S(к) + 2О2(г) =

 = 2Н2SO4(ж) + 2Н2О(ж) + 2SO2(г)
= 2Н2SO4(ж) + 2Н2О(ж) + 2SO2(г)
2S(к) + 2Н2(г) + 4О2(г) = 2Н2SO4(ж)
S(к) + Н2(г) + 2О2(г) = Н2SO4(ж)
Чтобы получить значение энтальпии образования серной кислоты H2SO4, надо те же алгебраические действия провести со значениями тепловых эффектов данных реакций.
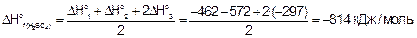
Ответ. Стандартная энтальпия образования H2SO4 равна -814 кДж/моль.
 2015-06-04
2015-06-04 2977
2977








