Показатели, необходимые для характеристики качества воды, определяются характером использования воды различными потребителями. Например, качество воды хозяйственно-питьевого назначения характеризуют с помощью показателей, не применяемых во внимание при использовании воды на ТЭС и АЭС. Здесь рассмотрим основные показатели, используемые при анализе природных вод, применяемых в теплоэнергетике как исходное сырьё.
Минеральные примеси различных природных вод по количественному составу примерно постоянны и отличаются лишь концентрациями, установление которых и входит в задачу анализа природных вод. Важнейшие показатели качества воды, определяющие применимость для паротурбинных установок и метод её обработки – концентрация грубодисперсных примесей (взвешенные вещества), концентрация ионов Ca2+, Mg2+, Fe2+, 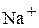 ,
, 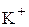 ,
, 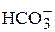 ,
, 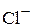 ,
, 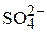 ,
, 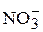 ,
, 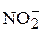 , рН воды, удельная электропроводимость, технологические показатели (сухой прокаленный остаток, щелочность, жесткость, кремнесодержание, окисляемость), концентрация растворённых газов
, рН воды, удельная электропроводимость, технологические показатели (сухой прокаленный остаток, щелочность, жесткость, кремнесодержание, окисляемость), концентрация растворённых газов 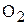 и
и 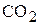 .
.
Содержание грубодисперсных (взвешенных) веществ выражают в (мг/кг) и определяют фильтрованием 1 л пробы воды через бумажный фильтр, который затем высушивают при температуре 105-110 0С до постоянной массы
Прозрачность воды определяют с помощью методов шрифта и креста. Для первого способа применяют градуированный на сантиметры стеклянный цилиндр высотой 30 см, под дно которого подложен определённый шрифт. Столб воды в сантиметрах, через который ещё можно прочесть текст, и определяет прозрачность воды. Прозрачность по кресту определяют по той же методике, используя трубку длиной 350 см, диаметром 3,0 см, на дно которой помещают бумажный круг с крестом, имеющим ширину линий в 1 мм.
Мутность воды пропорциональна содержанию в ней взвешенных частиц, определяют, сравнивая анализируемую пробу с определенным эталоном мутности.
Удельная электропроводность растворов χ, характеризуемая электро-проводностью 1 см3 жидкости с размером граней 1 см и выражаемая в См/см, является важным показателем качества природной и обрабатываемой воды, указывающим на суммарную концентрацию ионгенных примесей. Удельная электропроводность воды, не содержащей примесей, при 25 0С составляет 0,063 мкСм/см и определяется переносом в электрическом поле только ионов H+ и 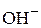 . При постоянной температуре и данной степени диссоциации существует прямая зависимость между концентрацией электролита и его удельной электропроводностью. Так удельную электропроводность водных растворов различных солей концентрацией 500 мк/кг в условном пересчете на NaCl можно оценить из соотношения
. При постоянной температуре и данной степени диссоциации существует прямая зависимость между концентрацией электролита и его удельной электропроводностью. Так удельную электропроводность водных растворов различных солей концентрацией 500 мк/кг в условном пересчете на NaCl можно оценить из соотношения
1 мкСм/см↨≈ 0,5 мг NaCl/кг H2O.
Сухой остаток (СО) (мг/л) определяют путем выпаривания определенного объёма предварительно профильтрованной пробы и последующего просушивания остатка при температуре 110-120 0С.
Сухой остаток выражает содержание растворенных в воде минеральных и органических примесей, нелетучих при указанной температуре. Содержащиеся в природной воде Ca(HCO3)2 и Mg(HCO3)2 при выпаривании разлагаются с выделением H2O и CO2 и в сухом остатке появляются CaCO3 и MgCO3; это надо иметь в виду, сравнивая сухой остаток с минеральным.
Минеральный остаток (мг/л) (общее солесодержание) подсчитывается путем суммирования концентраций катионов и анионов, определенных при проведении полного химического анализа воды.
Прокаленный остаток (мг/л) характеризует содержание в воде минеральных веществ; его определяют путем прокаливания при 800 0С сухого остатка. При прокаливании сгорают органические вещества и частично разлагаются карбонаты.
Окисляемость воды – это показатель, имеющий условное значение и представляющий собой расход какого-либо сильного окислителя, необходимого для окисления в определённых условиях органических примесей, которые содержатся в 1 л воды. Обычно для этих целей применяют перманганат калия (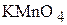 ) или бихромат калия (
) или бихромат калия (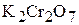 ), различают соответственно перманганатную и бихроматную окисляемость. Окисляемость воды выражают в кислородных или перманганатных единицах (мгO2/кг, мг
), различают соответственно перманганатную и бихроматную окисляемость. Окисляемость воды выражают в кислородных или перманганатных единицах (мгO2/кг, мг 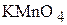 /кг), различающихся в 3,95 раза. Бихроматная окисляемость обычно превышает в 2-2,5 раза перманганатную, а разность между ними позволяет судить об устойчивости органических примесей к действию окислителей. При определении окисляемости обоих видов происходит окисление не только содержащихся в воде органических веществ, но и некоторых неорганических, например закисного железа, сероводорода, нитритов. Поэтому следует еще раз подчеркнуть, что окисляемость характеризует содержание в воде органических веществ лишь приближенно и условно.
/кг), различающихся в 3,95 раза. Бихроматная окисляемость обычно превышает в 2-2,5 раза перманганатную, а разность между ними позволяет судить об устойчивости органических примесей к действию окислителей. При определении окисляемости обоих видов происходит окисление не только содержащихся в воде органических веществ, но и некоторых неорганических, например закисного железа, сероводорода, нитритов. Поэтому следует еще раз подчеркнуть, что окисляемость характеризует содержание в воде органических веществ лишь приближенно и условно.
Окисляемость чистых грунтовых вод составляет обычно 1-3 мгO2/л, в то время как в водах поверхностных источников окисляемость повышается до 10-12 мгO2/л. Реки болотного происхождения и поверхностные источники в период паводка отличаются очень высокой окисляемостью, превышающей, например, 30 мгO2/л. Сточные воды, содержащие органические вещества и сбрасываемые в водоемы, могут повышать окисляемость воды различных источников.
Для суммарной оценки органических загрязнений воды в последнее время начинают применять метод сорбции из воды органических веществ активированным углем с последующим его высушиванием и экстракцией из него этих веществ хлороформом (метод угольно-хлороформного экстракта). В массовых единицах (мг/кг) оценивают в ряде случаев содержание общего органического углерода в воде.
Жесткость воды – один из важнейших показателей её качества. Общей жесткостью 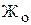 называют суммарную концентрацию ионов кальция и магния, выраженную в единицах микрограмм-эквивалент (мг-экв/л) на 1 л воды.
называют суммарную концентрацию ионов кальция и магния, выраженную в единицах микрограмм-эквивалент (мг-экв/л) на 1 л воды.
Жо = Жк + Жн.к..
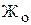 =
= 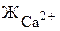 +
+ 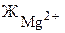
Общую жесткость воды подразделяют на кальцевую и магниевую. Кальциевая жесткость определяется катионами кальция Ca2+ (мг-экв/л). Магнивая жесткость определяется катионами магния Mg2+ (мг-экв/л). Часть 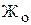 (в предельном случае при Що >
(в предельном случае при Що > 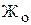 вся жесткость), эквивалентная содержанию бикарбонатов, называется карбонатной жесткостью; разность между общей и карбонатной жесткостями называется некарбонатной жесткостью.
вся жесткость), эквивалентная содержанию бикарбонатов, называется карбонатной жесткостью; разность между общей и карбонатной жесткостями называется некарбонатной жесткостью.
Общая жесткость подразделяется на карбонатную Жк и некарбонатную Жн.к. Карбонатная жесткость обусловливается наличием в воде бикарбонатов и карбонатов кальция и магния, некарбонатная жесткость – присутствием в воде хлоридов, нитратов, сульфатов кальция и магния (мг-экв/л).
Процесс выделения из воды ионов Ca2+и Mg2+ получил название умягчение воды. Воды с высокой жесткостью дают плотные отложения на теплопередающих поверхностях.
По значению общей жесткости природных вод установлена следующая класссификация: 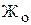 < 1,5 мг-экв/кг – малая жесткость,
< 1,5 мг-экв/кг – малая жесткость, 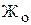 = 1-3,0 мг-экв/кг – средняя,
= 1-3,0 мг-экв/кг – средняя, 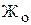 = 3,0-6,0 мг-экв/кг – повышенная,
= 3,0-6,0 мг-экв/кг – повышенная, 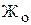 = 6,0-12,0 мг-экв/кг – высокая,
= 6,0-12,0 мг-экв/кг – высокая, 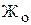 > 12 мг-экв/кг – очень высокая жесткость.
> 12 мг-экв/кг – очень высокая жесткость.
Общая щелочность воды Що – суммарная концентрация в воде растворимых гидрооксидов и анионов слабых кислот за вычетом концентрации ионов водорода.
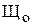 =
= 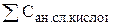 +
+ 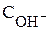 -
- 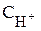 , мг/экв/л,
, мг/экв/л,
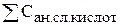 =
= 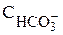 +
+ 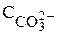 +
+ 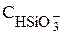 +
+ 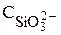 +
+ 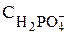 +
+ 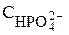 +
+
+ 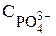 .
.
Общую щелочность Що выражают в миллиграмм − эквивалентах на 1 л. Её определяют титрованием пробы воды кислотой в присутствии индикаторов: фенолфталеина и метилоранжа. Для вод, в которых может содержаться гидратная форм щелочности (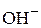 ), карбонатная
), карбонатная 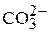 (
(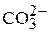 ) или бикарбонатная (
) или бикарбонатная (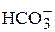 ), вычисление отдельных форм (слагаемых) общей щелочности определяют по таблице в зависимости от результатов титрования пробы с фенолфталеином –
), вычисление отдельных форм (слагаемых) общей щелочности определяют по таблице в зависимости от результатов титрования пробы с фенолфталеином – 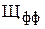 и метилоранжем –
и метилоранжем – 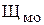 .
. 
Вычисление форм щелочности природной воды
| Соотношение Щфф | Гидраты Щг | Карбонаты Щк | Бикарбонаты Щб |
| Щфф = Щмо | Щфф; Щмо | Нет | Нет |
| Щфф > 0,5 Щмо | 2Щфф-Щмо | 2(Щмо-Щфф) | Нет |
| Щфф = 0,5 Щмо | Нет | Щмо; 2Щфф | Нет |
| Щфф < 0,5 Щмо | Нет | 2Щфф | Щмо-2Щфф |
| Щфф = 0; Щмо>0 | Нет | Нет | Щмо |
Природные воды в своем большинстве характеризуются бикарбонатной формой щелочности, которая численно близка к величине общей щелочности (Що~Щб).
В природных исходных водах соотношение между щелочностью и общей жесткостью могут быть различными, соответственно вычисляются значения карбонатной жесткости таблица:
| Щелочность исходной воды | Карбонатная жесткость исходной воды |
Щи.в < 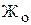 о о | Жк = Щи.в |
Щи.в = 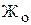 | Жк = 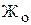 |
Щи.в > 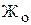 | Щи.в − Жк = 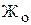 ; Щи.в − ; Щи.в − 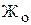 = [NaHCO3] = [NaHCO3] |
Ионный состав воды. Вода всегда электрически нейтральна, поэтому сумма концентраций содержащихся в ней катионов равна сумме концентраций анионов при условии, что они выражены в мг-экв/л: åск=åса.
Этой закономерностью, называемой уравнением электронейтральности раствора, пользуются при проверке правильности выполнения анализа воды. В водах энергетических объектов могут присутствовать ионы, приведенные в таблице
Ионный состав воды
| Катионы | Анионы |
Водород 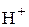 | Гидроксильный 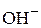 |
Натрий 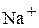 | Бикарбонатный 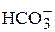 |
Калий 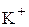 | Карбонатный 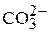 |
Аммоний 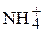 | Нитритный 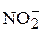 |
Кальций 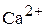 | Нитратный 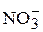 |
Магний 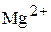 | Хлоридный 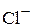 |
Железо двухвалентное 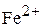 | Фторидный 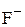 |
Железо трехвалентное 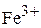 | Сульфатный 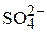 |
Алюминий 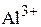 | Силикатный 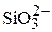 |
Медь 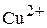 | Ортофосфатный 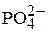 |
Гидросульфатный 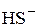 |
В природных водах обычно содержится катионы 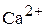 ,
, 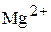 ,
, 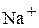 , и анионы
, и анионы 
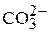 ,
, 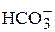 ,
, 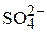 ,
, 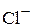 , реже
, реже 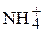 ,
, 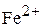 и
и 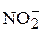 ,
, 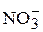 ,
, 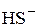 .
.
Ионы натрия и калия с анионами природных вод не образуют труднорастворимых простых солей, практически не подвергаются гидролизу, поэтому их относят к группе устойчивых примесей. Концентрация ионов натрия и калия изменяется только в результате испарения или разбавления природной воды, при анализе воды ее часто выражают суммарно.
Ионы кальция и магния относятся к числу важнейших примесей воды и во многом определяют возможность ее использования для различных народнохозяйственных целей, так как эти ионы образуют труднорастворимые соединения с некоторыми находящимися в воде анионами. При использовании природной воды и связанном с этим изменении исходных концентраций катионов и анионов, например при упаривании или снижении растворимости с ростом температуры, происходит выделение труднорастворимых солей кальция и магния на теплопередающих поверхностях в виде твердой фазы.
Ионы железа характеризуются поливалентностью и могут находиться в различных формах: Fe2+ и Fe3+. Во всех природных водах с высоким рН ионы Fe3+ практически не могут содержаться и все соединения Fe3+ находятся коллоидной или грубодисперсной форме. В подземных водах железо обычно находится в ионной форме в виде двухвалентного железа, стехиметрически отвечающего формуле соединения 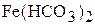 , которое при условии удаления растворенной углекислоты (выдерживание в открытом сосуде) легко гидролизуется, а при наличии в воде растворенного кислорода окисляется с образованием краснокоричневой твердой фазы гидроксида железа Fe(OH)3:
, которое при условии удаления растворенной углекислоты (выдерживание в открытом сосуде) легко гидролизуется, а при наличии в воде растворенного кислорода окисляется с образованием краснокоричневой твердой фазы гидроксида железа Fe(OH)3:
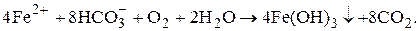
В водах поверхностных источников железо может входить также в состав органических соединений; присутствие в воде соединений железа в повышенных концентрациях создает условия для развития железобактерий, образующих бугристые колонии на стенках трубопроводов.
Концентрация железа в исходной воде может увеличиваться в процессе загрязнения продуктами коррозии.
 2015-06-05
2015-06-05 3177
3177
