Организмы животных и растений, гидросфера, земная кора и недра, космическое пространство часто представляют собой вещества в раздробленном, или, как говорят, дисперсном, состоянии. Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Химия дисперсного состояния довольно новая наука, но она почти не изучается ни в школе, ни в нехимических высших учебных заведениях, хотя эта научная область имеет не меньшее значение для нашей жизни, чем химия комплексных и органических соединений. Читая эту главу, постоянно думайте, когда и где вы встречаете описываемое явление в природе, быту или производстве, а также, как можно его использовать.
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе (рис. 5.1).
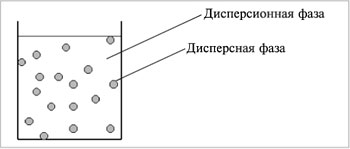 |
| Рис. 5.1. Дисперсная система |
Размер частиц дисперсной фазы характеризуется дисперсностью. В зависимости от нее дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные).
Размер частиц низкодисперсных систем составляет 10–3 мм и больше. Размер частиц высокодисперсных систем лежит в интервале 10–6–10–4 мм (от 1 до 100 нм), что, как минимум, на порядок больше размера частиц в истинных растворах ( 10–7 мм). Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности).
10–7 мм). Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности).
От названия коллоидных систем произошло название отдельной области химии – коллоидной. «Коллоидная химия» – традиционное название химии дисперсных систем и поверхностных явлений. Раньше коллоидами называли клееподобные вещества, теперь это высокодисперсные системы с сильно развитой поверхностью раздела фаз. Ниже мы будем использовать старые традиционные термины, понимая их современный смысл. Например, под выражением «коллоидный раствор» будем иметь в виду высокодисперсное состояние вещества в воде в качестве дисперсионной среды.
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. При диспергировании, или измельчении, вещества происходит значительное увеличение площади поверхности частиц (при постоянном суммарном их объеме). При этом энергия, затрачиваемая на измельчение и на преодоление сил притяжения между образующимися частицами, переходит в энергию поверхностного слоя – поверхностную энергию. Чем выше степень измельчения, тем больше поверхностная энергия. Поэтому область химии дисперсных систем (и коллоидных растворов) считают химией поверхностных явлений.
Коллоидные частицы настолько малы (содержат 103–109 атомов), что не задерживаются обычными фильтрами, не видны в обычный микроскоп, не оседают под действием силы тяжести. Их устойчивость со временем снижается, т.е. они подвержены «старению». Дисперсные системы термодинамически неустойчивы и стремятся к состоянию с наименьшей энергией, когда поверхностная энергия частиц становится минимальной. Это достигается за счет уменьшения общей площади поверхности при укрупнении частиц (что может также происходить при адсорбции на поверхности частиц других веществ).
Свойства вещества в раздробленном, или дисперсном, состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии, т.е. в виде куска твердого тела или некоторого объема жидкости.
Так, давление пара воды над плоской поверхностью при 20 °С равно 2333 Па, но над каплями воды радиусом 1 мм оно выше на 0,003 Па, а над каплями радиусом 0,01 мм – на 0,3 Па. Кристаллический гидрат оксида алюминия Al2О3•3Н2О (или Al(ОН)3) начинает терять воду при 200 °С, а в очень мелкораздробленном состоянии – при 100 °С. Золото в соляной кислоте не растворяется, однако в высокодисперсном состоянии легко переходит в раствор. Растворимость СаSО4 в воде составляет 4,9•10–3 моль/л, но для частиц СаSО4 размером 2•10–4 см она повышается до 1,5•10–3 моль/л.
В связи с тем, что поверхностная энергия маленькой частицы выше, чем более крупной, термодинамические свойства их различны. Так, растворимость мельчайших кристалликов выше, чем больших, и происходит перенос вещества из высокодисперсной фазы в менее дисперсную, т.е. крупные кристаллы растут за счет растворения мелких. В этом самопроизвольном процессе
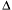 G < 0.
G < 0.
Давление пара над маленькой каплей выше, чем над большой, и большие капли вырастают за счет испарения маленьких (рис. 5.2). Поэтому в облаках образуются капли дождя, точно так же растут снежинки.
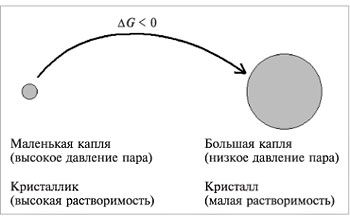 |
| Рис. 5.2 Схема переноса вещества из высокодисперсного состояния в низкодисперсное |
Вещество в дисперсном состоянии стремится поглотить другие вещества. Растворимость газов в каплях выше, чем в жидкости большого объема. Из-за того, что растворимость кислорода в капле воды высока, коррозия железа проходит даже без примесей в железе других веществ (рис. 5.3). Под каплей воды на поверхности железа коррозия проявляется в первую очередь у краев капли, где растворимость кислорода больше.
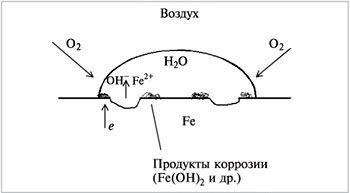 |
| Рис. 5.3. Схема коррозии железа под маленькой каплей воды |
Существует несколько различных классификаций дисперсных систем: по размеру частиц, по фазовому состоянию дисперсной фазы и дисперсионной среды, по характеру взаимодействия частиц дисперсной фазы с веществом дисперсионной среды, по термодинамической и кинетической устойчивости дисперсных систем и т.п.
Классификация дисперсных систем по фазовому состоянию дисперсной фазы и дисперсионной среды приведена в таблице.
Таблица
 2015-06-05
2015-06-05 1208
1208
