Гидрокарбонат-ионы (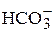 ) – важнейшая составная часть солевых компонентов воды. В природных водах кроме «полусвязанной» углекислоты (ионы
) – важнейшая составная часть солевых компонентов воды. В природных водах кроме «полусвязанной» углекислоты (ионы 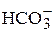 - называемые бикарбонатами), а в некоторых случаях и «связанной» углекислоты (ионы
- называемые бикарбонатами), а в некоторых случаях и «связанной» углекислоты (ионы 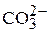 ) содержится также так называемая «свободная» углекислота, находящаяся в виде растворенного в воде газа СО2 и его гидрата – молекул Н2СО3. между различными формами угольной кислоты существует кинетическое равновесие, связанное с величиной рН и содержанием ионов кальция в растворе.
) содержится также так называемая «свободная» углекислота, находящаяся в виде растворенного в воде газа СО2 и его гидрата – молекул Н2СО3. между различными формами угольной кислоты существует кинетическое равновесие, связанное с величиной рН и содержанием ионов кальция в растворе.
Хлорид-ионы (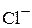 ) с катионами, обычно находящимися в природных водах, не образуют труднорастворимых солей и при температуре около 25°С не подвергаются гидролизу или окислению.
) с катионами, обычно находящимися в природных водах, не образуют труднорастворимых солей и при температуре около 25°С не подвергаются гидролизу или окислению.
Сульфат-ионы (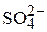 ) в поверхностных водах, не загрязненных органическими веществами, достаточно устойчивы, как анионы сильной кислоты они не подвергаются гидролизу и образуют относительно труднорастворимую соль только с одним из катионов природных вод – Са2+. Однако растворимость сульфата кальция при обычной температуре достаточно высока (около 1 г/кг), и при природных водах, как правило, не происходит выделения твердой фазы СаSO4.
) в поверхностных водах, не загрязненных органическими веществами, достаточно устойчивы, как анионы сильной кислоты они не подвергаются гидролизу и образуют относительно труднорастворимую соль только с одним из катионов природных вод – Са2+. Однако растворимость сульфата кальция при обычной температуре достаточно высока (около 1 г/кг), и при природных водах, как правило, не происходит выделения твердой фазы СаSO4.
Наличие в природных водах соединений азота, а именно ионов аммония (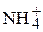 ), нитритов (
), нитритов (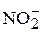 ) и нитратов (
) и нитратов (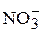 ), указывает на загрязнение источника водоснабжения хозяйственно-бытовыми стоками.
), указывает на загрязнение источника водоснабжения хозяйственно-бытовыми стоками.
Химически чистая вода является очень слабым электролитом, только одна из десяти миллионов молекул диссоциирует на ионы 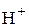 и
и 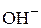 :
:
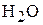
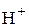 +
+ 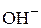 .
.
Отрицательный логарифм концентрации водородных ионов, называемый водородным показателем рН, для химически чистой воды равен 7. В зависимости от значения рН водного раствора оценивают реакцию среды
| Реакция среды | Значение рН |
| Кислая | 1-3 |
| Слабокислая | 4-6 |
| Нейтральная | |
| Слабощелочная | 8-10 |
| Щелочная | 11-14 |
Вода для питьевых целей имеет рН = 6,5-9,0 (ГОСТ 2874-82).
Растворённые газы. Для вод, используемых для энергетических целей, важное значение имеют растворенные в воде газы: кислород, углекислота, сероводород, аммиак.
Кислород поступает в воду из воздуха, где его содержится около 2,1 %. Концентрация кислорода в поверхностных водах близка к значению растворимости его при данной температуре и давлении.
Основным источником поступления в воду углекислоты (содержание 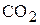 в воздухе невелико – всего 0,04 %) являются биохимические процессы разложения органических веществ в природе. Растворяясь в воде,
в воздухе невелико – всего 0,04 %) являются биохимические процессы разложения органических веществ в природе. Растворяясь в воде, 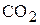 реагирует с водой, образуя гидратированную форму
реагирует с водой, образуя гидратированную форму 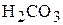 .
.
При диссоциации угольной кислоты в водном растворе соотношение между ее формами 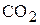 ,
, 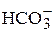 и
и 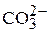 при данной температуре зависит от концентрации водородных ионов, т.е. значения рН.
при данной температуре зависит от концентрации водородных ионов, т.е. значения рН.
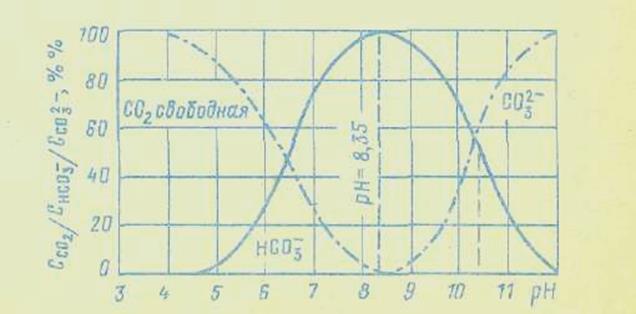
|
Соотношение форм углекислоты в зависимости от рН воды (при t=25°С)
Из рисунка видно, что при рН=4,3 вся находящаяся в воде углекислота представлена практически только одним соединением 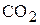 и ее гидратированной формой Н2СО3, составляющей, однако, лишь десятые доли процента суммарной концентрации (
и ее гидратированной формой Н2СО3, составляющей, однако, лишь десятые доли процента суммарной концентрации (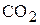 +Н2СО3). С увеличением рН доля
+Н2СО3). С увеличением рН доля 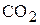 уменьшается при одновременном увеличении доли
уменьшается при одновременном увеличении доли 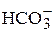 , и при значении рН до 12 она представлена только ионами
, и при значении рН до 12 она представлена только ионами 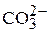 .
.
Существующие между различными формами угольной кислоты равновесие суммарно выражается уравнением
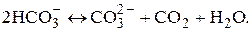
 2015-06-05
2015-06-05 642
642








