Цель занятия: применение теоретических знаний для решения задач.
Подготовка к занятию: лекции № 22–25. Касьянов В.А. Физика-10 § 37, 39–44.
В-1
Задание на занятие:
1. Сколько молекул содержится в углекислом газе (CO2) массой 20 г?
2. Рассчитайте давление, которое производят молекулы газа на стенки сосуда, если масса газа 3 г, объём 0,5×10-3 м3, а средняя квадратичная скорость молекул 500 м/с.
3. Какова средняя квадратичная скорость молекул гелия при 27 °C?
4. В процессе изохорного охлаждения давление газа уменьшилось в 3 раза. Какой была начальная температура газа, если конечная температура стала равной 27 °C?
5. При давлении 105 Па и температуре 15 °C воздух имеет объем 2 л. При каком давлении воздух данной массы займет объем 4 л, если температура его станет равной 20 °C?
6. Какова внутренняя энергия одноатомного газа, занимающего при температуре 400 К объем 2,5 л, если концентрация его молекул 1020 см-3?
7.  Чему равна концентрация молекул идеального одноатомного газа в сосуде объемом 2 л при температуре 27 °C, если внутренняя энергия равна 300 Дж?
Чему равна концентрация молекул идеального одноатомного газа в сосуде объемом 2 л при температуре 27 °C, если внутренняя энергия равна 300 Дж?
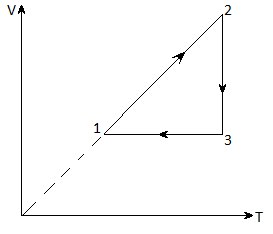
8. На рисунке дан график изменения состояния идеального газа в координатах V – T. Представьте этот процесс на графиках в координатах p – V и p – T.
9. Оцените диаметр атома углерода, зная значение плотности алмаза, которая равна 3515 кг/ м3.
В-2
Задание на занятие:
1. Найти число атомов в свинцовом предмете массой 234 г.
2. Определите, при какой температуре средняя квадратичная скорость молекул кислорода равна 500 м/с.
3. Сколько молекул содержится в 2 м3 газа при давлении 150 кПа и температуре 27 °C?
4. В баллоне объемом 200 л находится гелий под давлением 100 кПа при температуре 17 °C. После подкачивания гелия его давление поднялось до 300кПа, а температура увеличилась до 47 °C. На сколько увеличилась масса гелия?
5. В процессе изобарного охлаждения объем идеального газа уменьшился в 2 раза. Какова конечная температура газа, если его начальная температура равна 819 °C? Масса газа постоянна.
6. Газ, расширяясь изобарно при добавлении 2 • 105 Па, совершает работу 200 Дж. Определите первоначальный объем газа, если его конечный объем оказался равным 2,5 л.
7.  В цилиндре объемом 24 л находится газ, который изобарно расширяется под давлением 5 • 105 Па. Каков конечный объем газа, если при его расширении совершается работа в 1,5 кДж?
В цилиндре объемом 24 л находится газ, который изобарно расширяется под давлением 5 • 105 Па. Каков конечный объем газа, если при его расширении совершается работа в 1,5 кДж?
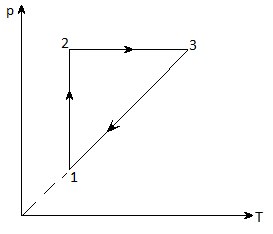
8. На рисунке дан график изменения состояния идеального газа в координатах p – T. Представьте этот процесс в координатах p – V и V – T.
9. В озеро, имеющее среднюю глубину 10 м и площадь поверхности 20 км2, бросили кристаллик поваренной соли массой 0,01 г. Сколько молекул соли оказалось бы в наперстке воды объемом 2 см3, зачерпнутой из озера, если полагать, что соль, растворившись, рвномерно распределилась во всем объеме воды?
Содержание отчёта:
1. Записать наименование и цель занятия.
2. Ответить на контрольные вопросы и получить допуск к работе.
3. Выполнить задания.
Контрольные вопросы:
1. Сформулировать основные положения МКТ.
2. Записать число Авогадро. Как рассчитать число молекул вещества?
3. Записать зависимость температуры от средней кинетической энергии. Чему равна постоянная Больцмана? Как перевести значение температуры, выраженной в градусах Цельсия в Кельвины?
4. Записать основное уравнение МКТ и универсальную газовую постоянную.
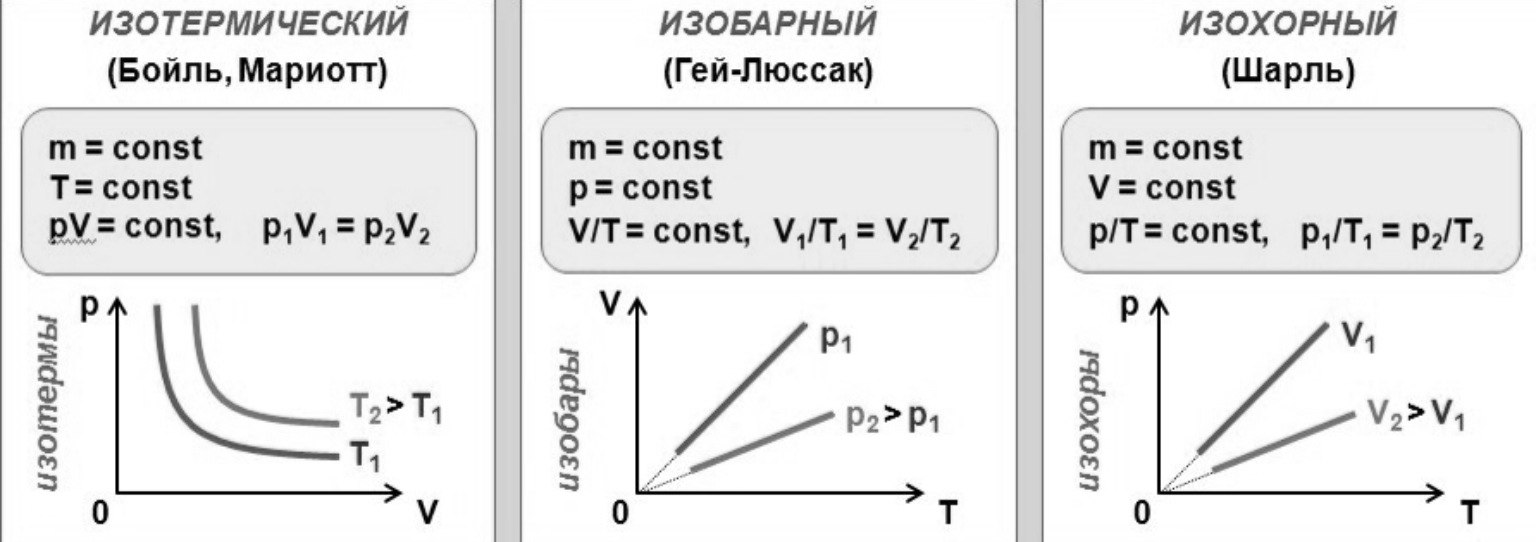
5. Сформулировать газовые законы для данной массы газа.
ПРИЛОЖЕНИЕ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Любое вещество состоит из мельчайших частиц — молекул и атомов. Они расположены в пространстве дискретно, то есть на некоторых расстояниях друг от друга.
2. Атомы или молекулы вещества находятся в состоянии беспорядочного движения, которое никогда не прекращается.
3. Атомы или молекулы вещества взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами.
Атом — это наименьшая частица данного химического элемента, сохраняющая все его химические свойства. Химических элементов не так много — все они сведены в таблицу Менделеева.
Молекула — это наименьшая частица данного вещества (не являющегося химическим элементом), сохраняющая все его химические свойства. Молекула состоит из двух или более атомов одного или нескольких химических элементов.
Количество вещества- физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
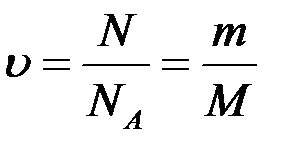
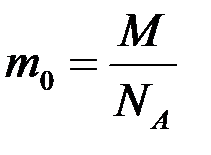
МОЛЬ - это количество вещества, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Основное уравнение МКТ:
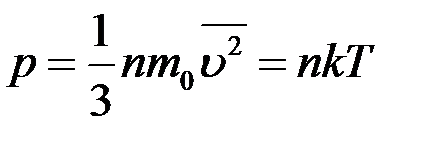
Уравнение состояния идеального газа:
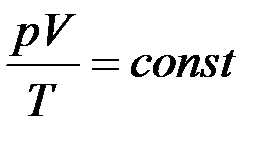 , при
, при 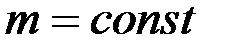
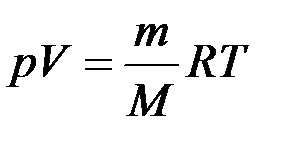
Изопроцессы и газовые законы:
Практическое занятие № 6.
 2015-06-05
2015-06-05 3220
3220
