Гидроксикислоты - химически активные вещества. Наличие в составе их молекул двух видов функциональных групп (- СООН и - ОН) позволяет им легко вступать в различные химические реакции, характерные для карбоновых кислот, спиртов и типичные для самых гидроксикислот.
Реакции окисления за спиртовыми группами
Гидроксикислоты легко вступают в реакции окисления за спиртовыми группами, обуславливает образование оксикислот - альдегидо - и кетокислот.Например, молочная кислота, окисляясь, превращается в пировиноградную: СН3СН(ОН)СООН + [О] = СН3С(О)СООН + Н2О (Молочная кислота → пировиноградная кислота) Окисление оксикислот при нагревании с концентрированными минеральными кислотами При нагревании с концентрированной серной кислотой лимонная кислота сначала разлагается на муравьиную и ацетондикарбонову кислоты:
НООС-СН2-С(ОН)(СООН)-СН2-СООН + Н2SО4 = НСООН + HOOC-СН2-С(О)-Н2С-СООН
Лимонная кислота→муравьиная кислота + ацетондикарбоновая кислота
В подобную реакцию вступает и молочная кислота СН3СН(ОН)СООН + Н2SО4 = НСООН + СН3-СHO молочная кислота→ацетальдегид Образование солей Оксикислоты реагируют с гидроксидами или солями металлов, образуя кислые или средние соли. Например, образование кислой и средней солей тартратнои кислоты: На первой стадии образуется кислая соль тартратнои кислоты, которая практически не растворяется в воде:
НООС-СН(ОН)-СН(ОН)-СООН + КОН = НООС-СН(ОН)-СН(ОН)-СООК + Н2О
Тартратная кислота → Гидрогенкалий тартар
На второй стадии образуется средняя соль, которая хорошо растворяется в воде:
НООС-СН(ОН)-СН(ОН)-СООК + КОН = КООС-СН(ОН)-СН(ОН)-СООК + Н2О Гидрогенкалий тартар → калий тартар. При взаимодействии молочной кислоты и гидроксида цинка образуется лактат цинка: 2СН3СН(ОН)СООН + Zn(OH)2 = (СН3СН(ОН)СОО)2Zn + 2H2O Молочная кислота → Лактат цинка
Лимонная кислота реагирует с хлоридом кальция образуя цитрат кальция:
НООС-СН2-С(СООН)(ОН)-СООН + СаСl2 = [ООС-СН2-С(ОН)(COO)-СОО]*Ca3 + 6HCl
Лимонная кислота→ цитрат кальция
Рацемат — эквимолярная смесь двух энантиомеров. Рацематы не обладают оптической активностью, а также отличаются по свойствам от индивидуальных энантиомеров. Являются продуктами нестереоселективных реакций В 1815 г. было обнаружено, что некоторые органические вещества способны вращать плоскость поляризации света. Такие соединения называют оптически активными. Они существуют в природе в виде двух изомеров, один из которых вращает плоскость поляризации вправо, а другой – влево. Для обозначения этих направлений вращения используют знаки (+) и (–), которые ставят перед формулой оптического изомера. Такие изомеры называют антиподами или энантиомерами – противоположный).Смесь,состоящая из равных масс(+) и (–) изомеров, называют рацемической смесью или рацематом. Рацемат оптически неактивен в результате взаимной компенсации оптической активности входящих в него оптических изомеров. Показано, что среди органических веществ оптической активностью обладают соединения асимметрического строения, содержащие асимметрический атом углерода, т.е. атом (C*), у которого все четыре валентности затрачены на соединение с различными атомами или группами атомов.
Любое органическое соединение, содержащее асимметрический углерод, можно представить в виде двух пространственных форм, которые не совмещаются в пространстве друг с другом например: 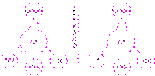
Рис.Оптические антиподы молочной кислоты
При изображении формул оптически активных веществ обычно используют проекционные формулы Э. Фишера – проекции тетраэдрических моделей на плоскость 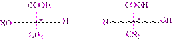
молочная кислота
Оптические изомеры (антиподы) различаются не только знаком вращения, но и конфигурацией. Было условно принято, что оптически актив-ные соединения, у которых на проекционной формуле гидроксил находится слева от C*, относятся кL-ряду, справа – кD-ряду. В качестве стандарта был выбран глицериновый альдегид (М.А. Розанов, 1906 г.). 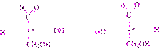 D(+)-глицериновый альдегидL(–)-глицериновый альдегид
D(+)-глицериновый альдегидL(–)-глицериновый альдегид
Знаки конфигурации (DиL) и знаки вращения ((+) и (–)) никак не взаимосвязаны (совпадение у глицеринового альдегида – случайное).
Энантиомеры (антиподы), кроме знака вращения плоскости поляризации, ничем не отличаются друг от друга: их физические и химические свойства совершенно одинаковы. Однако антиподы резко различаются по своим физиологическим свойствам. Так, например, D-аспа-рагин сладок, аL-аспарагин безвкусен;L-никотин в 3 раза более ядовит, чемD-никотин;L-адреналин фармакологически значительно более активен, чемD-адреналин.
Соединения с несколькими C* имеют количество оптически активных изомеровN, определяемое по формулеN= 2n, гдеn– количество асимметрических атомов углерода. Так, в молекуле винной кислотыHOOC–*CHOH–*CHOH–COOHдва асимметрических атома и должно быть четыре стереоизомера 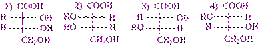 Каждый C* в молекуле винной кислоты может обеспечить или левое (–) или правое (+) вращение. Возможны следующие комбинации:
Каждый C* в молекуле винной кислоты может обеспечить или левое (–) или правое (+) вращение. Возможны следующие комбинации:  в плоскости чертежа совмещаются, т.е. это одна и та же молекула, получившая название мезовинной кислоты, не обладающая оптической активностью вследствие внутримолекулярной компенсации.°Из сопоставления формул видно, что структуры (1) и (2) являются оптическими антиподами, а (3) и (4) при повороте на 180
в плоскости чертежа совмещаются, т.е. это одна и та же молекула, получившая название мезовинной кислоты, не обладающая оптической активностью вследствие внутримолекулярной компенсации.°Из сопоставления формул видно, что структуры (1) и (2) являются оптическими антиподами, а (3) и (4) при повороте на 180
Синтетически и биохимически получаются, как правило, рацемические смеси, разделение которых на оптически активные компоненты представляет трудную задачу. Эффективными являются три метода разделениянеактивных форм на активные:
1) физический. При кристаллизации некоторых рацемических смесей антиподы образуют отличающиеся друг от друга кристаллы, которые могут быть разделены механическим путем;
2) биохимический. Основан на способности отдельных видов микроорганизмов предпочтительнее поглощать из рацемической смеси только один из антиподов;
3) химический. Используется способность оптических антиподов при взаимодействии с оптически активным реагентом образовывать соединения, которые существенно отличаются по свойствам (в частности, по растворимости).
Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга[1]. Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположныеконфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если конфигурация различается лишь у некоторых (а не у всех) стереоцентров, то такие стереизомеры являются диастереомерами[2]. Если диастереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами.
К диастереомерам также относят соединения с различной конфигурацией двойной связи (геометрические изомеры). В отличие от энантиомеров, диастереомеры различаются по физическим свойствам и реакционной способности.
 2015-06-05
2015-06-05 2311
2311
