Химические свойства Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами,азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения): 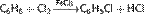
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана 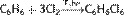 Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов: 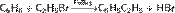
Реакции сульфирования и нитрования (электрофильное замещение): 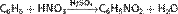
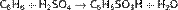
Горение бензола: 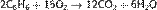
Типовые реакции ароматического электрофильного замещения 1. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений: 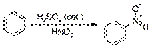 Образование активной частицы:
Образование активной частицы: 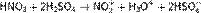 2. Сульфирование бензола с получением сульфокислоты:
2. Сульфирование бензола с получением сульфокислоты: 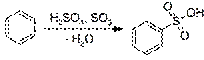 Активной частицей в реакции является SO3. 3. Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III):
Активной частицей в реакции является SO3. 3. Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III): 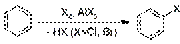 Образование активной частицы:
Образование активной частицы:
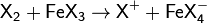 4. Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.
4. Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса. 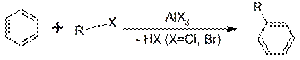 Реакционная способность и ориентация в производных бензола[править | править вики-текст] Заместители в бензольном кольце могут как способствовать реакции замещения (активирующие заместители), так и замедлять скорость реакции (дезактвирующие заместители). Некоторые группы ориентируют замещение в орто- и пара- положения, другие — в мета. Влияние различных групп на реакционную способность объясняется устойчивостью, иначе говоря энергией активации, требующейся для получения трех возможных промежуточных интермедиатов. В замещенных бензолах возможна так называемая ипсо-атака, то есть замещение имеющегося заместителя на другой:
Реакционная способность и ориентация в производных бензола[править | править вики-текст] Заместители в бензольном кольце могут как способствовать реакции замещения (активирующие заместители), так и замедлять скорость реакции (дезактвирующие заместители). Некоторые группы ориентируют замещение в орто- и пара- положения, другие — в мета. Влияние различных групп на реакционную способность объясняется устойчивостью, иначе говоря энергией активации, требующейся для получения трех возможных промежуточных интермедиатов. В замещенных бензолах возможна так называемая ипсо-атака, то есть замещение имеющегося заместителя на другой: 
================================================================================
76). Ароматические нитросоединения. Строение нитрогруппы. Получение нитросоединений ароматического ряда. Методы получения Нитрование аренов Это основной метод получения нитроаренов; подробно рассмотрен при изучении электрофильного ароматического замещения (см. лек.№18). Окисление ариламинов Метод заключается в окислении первичных ароматических аминов пероксисоединениями. Наиболее эффективным реагентом для окисления является трифторпероксиуксусная кислота в хлористом метилене. Трифторпероксиуксусную кислоту получают непосредственно в реакционной смеси при взаимодействии ангидрида трифторуксусной кислоты и 90%-ной перекиси водорода. Этот метод имеет значение для синтеза нитросоединений, содержащих в орто- и пара-положениях к нитрогруппе другие электроноакцепторные группировки, например: 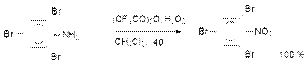
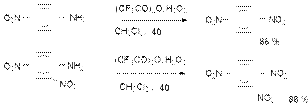
2. Физические свойства и строение Нитроарены – желтые вещества со своеобразным запахом. Нитробензол - жидкость с запахом горького миндаля. Ди- и полинитроарены – кристаллические вещества.
Нитрогруппа является сильным электроноакцептором, поэтому нитроарены имеют большие дипольные моменты, направленные в сторону нитрогруппы. 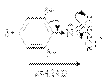
Молекулы полинитроаренов являются сильными электроноакцепторами. Например, сродство к электрону 1,3-динитробензола составляет 1,35 эВ, а 1,3,5-тринитробензола – 1,75 эВ.
=================================================================================
 2015-06-05
2015-06-05 2450
2450
