Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры. В химии широко пользуются понятием элемента – определённого вида атомов с одинаковым зарядом ядра (ионы, изотопы и т.д.). Значение заряда ядра атома служит отличительным признаком для различных видов атомов.. В настоящее время известно 114 элементов, но нас будут интересовать только природные 89 элемента от водорода Н до урана U. Вещество может быть простым, т.е. состоять из атомов одного элемента и сложным, т.е. представленным атомами различных элементов. Например, простыми являются газы – кислород O2 и озон O3, а вода H2O – сложное вещество.
Атом –это наименьшая частица элемента, входящая в состав молекул простых и сложных веществ. Молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и строением.
С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов.
Массы атомов чрезвычайно малы. Так, например, масса атома водорода составляет 1.674×10-27 кг, а масса атома урана 3.953×10-25 кг. В химии традиционно используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы (а.е.м.), которая представляет собой 1/12 часть массы атома изотопа углерода 12C, что составляет 1.66054×10-27 кг. Поэтому относительной атомной массой Ar химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Например, относительная атомная масса урана составляет
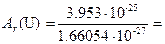 238.06.
238.06.
Современные значения атомных масс приведены в Периодической системе элементов.
Относительной молекулярной массой Mr вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава элемента к 1/12 массы атома углерода 12C. Относительная молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Например,
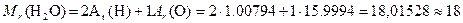
В Международной системе единиц (СИ) за единицу количества вещества принят моль. Чтобы научиться пользоваться этой величиной, сначала определим элементарную единицу вещества. Определим число атомов точно в 12 г 12С:
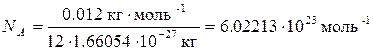
Это число называется постоянной Авогадро (NA). Теперь можно сказать, что 1 моль любого вещества – это такое его количество, которое содержит NA элементарных единиц.
Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность г/моль. Обычно её обозначают буквой M.
Молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества. Например, молярная масса газообразного кислорода M (O2) = 2×16 = 32 г/моль, а самородного золота M (Au) = 197 г/моль.
Газы при низких давлениях можно описать как ансамбль несвязанных друг с другом молекул (идеальный газ). Идеальные газы подчиняются закону Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Если известна масса или количество газа, а надо вычислить его объём, или наоборот, используют уравнение Менделеева-Клапейрона: 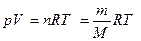 ,
,
где p – давление газа, Па; V – его объём, м3; T – температура в абсолютной шкале, K; n – количество вещества газа, моль; m – масса, г; M – молярная масса газа, г/моль; R = 8.31441 Дж/(моль×К) – универсальная газовая постоянная. При нормальных условиях (температуре 273.15 К и давлении 101325 Па) один моль идеального газа занимает объём равный 22.41 л.
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами [i], называют химическими превращениями, химическими реакциями или химическими взаимодействиями. При записи уравнения химической реакции следует помнить, что в соответствии с законом сохранения массы число атомов каждого типа, вступающих в реакцию, должно быть равно числу атомов этого же типа в продуктах реакции (баланс массы). Если в реакции участвуют заряженные частицы (ионы), то следует также учитывать баланс заряда. Например, уравнение реакции окисления иона Mn2+ кислородом воздуха запишется в виде
2×Mn2+ + O2 + 2×H2O Þ 2×MnO2 + 4H+
Коэффициенты, стоящие в этом уравнении перед формулами соединений, называются стехиометрическими и необходимы для выполнения условий баланса масс и зарядов.
 2015-06-05
2015-06-05 5746
5746








