Основные понятия и определения.
Количество вещества n – это число молей данного вещества. 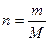
m(г) – масса растворенного вещества, М – молярная масса вещества.
Моль – количество вещества (в граммах), численно равное молекулярной
массе вещества. (1 моль воды Н2О – 18 граммов).
Плотность раствора 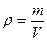 [г/мл], m(г) – масса раствора, V(мл) – объем
[г/мл], m(г) – масса раствора, V(мл) – объем
раствора. ρ [мг/дм3] = ρ[г/м3]
2.2.1 Массовая доля δ растворенного вещества В – отношение массы вещества к массе раствора: 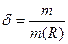 m - масса растворенного вещества; m(R) масса раствора; т.к. масса раствора m(R) = m + m(RS), где m(RS) – масса растворенного вещества, следовательно
m - масса растворенного вещества; m(R) масса раствора; т.к. масса раствора m(R) = m + m(RS), где m(RS) – масса растворенного вещества, следовательно 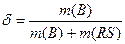 . Если известна плотность раствора ρ(г/мл), тогда масса раствора m(R) = ρ×V, масса растворенного вещества m(B) = δ×ρ×V
. Если известна плотность раствора ρ(г/мл), тогда масса раствора m(R) = ρ×V, масса растворенного вещества m(B) = δ×ρ×V
Если плотность раствора не указана, можно считать, что ρ = 1(г/мл)
Задача.: Вычислить массовую долю азотнокислого аммония NH4NO3,
если в 230 г воды растворили 20 г соли.
Решение: масса растворенного вещества m(B) = 20 г, масса раствора
m(R) = 230 + 20 = 250 г, δ = 20/250 = 0,08.
Задача. Вычислить массу сульфата натрия Na2SO4 в растворе объемом
0,2 л с δ = 0,1 и ρ = 1,05(г/мл) = 1050 (г/л).
Решение: m = δ×ρ×V = 0,1×1050×0,2 = 21г.
2.2.2. Процентное содержание вещества в растворе ω% = δ×100%
Задача: приготовить 60 г 40% раствора сернокислого железа FeSO4.
Решение: в 100 г раствора должно содержаться 40 г FeSO4. Составляем пропорцию: раствор вещество
100 г ------ 40 г (Fe SO4)
60 г ------ х г х = 24 г.
Для приготовления 60 г раствора надо взять 24 г соли и 60 – 24 = 36 г воды.
Задача. Из 60% раствора серной кислоты и 10% раствора серной кислоты приготовить 5 л 40% раствор кислоты.
Решение: если I раствора взять х(л), II раствора у(л), тогда кислоты в растворе будет δ1×х + δ2×у, объем раствора (х + у) литров. 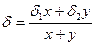 ; по условию
; по условию
δ = 0,4, следовательно, 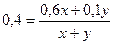 , 2х = 3у и х + у = 5; у = 2л, х = 3л.
, 2х = 3у и х + у = 5; у = 2л, х = 3л.
2.2.3. Мольная доля χ(В) растворенного вещества – отношение количества
растворенного вещества (в молях) к суммарному числу молей в растворе,
с учетом числа молей растворителя.
Задача: определить мольную долю ионов Na+ в растворе, если 29 г
NaCl растворили в 360 г воды.
Решение: NaCl = Na+ + Cl–; при растворении одного моля соли в растворе будет 1моль ионов натрия и 1моль ионов хлора. 29 г соли это 29/58 = 0,5 моля соли, следовательно, в растворе будет 0,5 моля Na+, 0,5 моля Cl– и 360/18 = 20 молей воды. χ(Na+) = 0,5/(0,5 + 0,5 + 20) ≈ 0,024.
2.2.4. Молярная концентрация вещества в растворе – это отношение
количества растворенного вещества к объему раствора, Св = nВ/Vr;
nВ – число молей растворенного вещества, Vr – объем раствора в литрах.
Т.к. 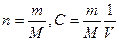 [C] = моль/литр, [m] = г, [V] = литр, М – молярная масса растворенного вещества. Если [V] = мл, тогда
[C] = моль/литр, [m] = г, [V] = литр, М – молярная масса растворенного вещества. Если [V] = мл, тогда 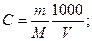
масса растворенного вещества 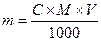 , если [V] = мл.
, если [V] = мл.
Запись 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля
серной кислоты, т.е. 2×98 = 196 г кислоты.
Задача. Вычислить молярную концентрацию раствора серной кислоты,
H2SO4, если плотность раствора ρ = 1176 (г/л) и массовая доля
кислоты в растворе δ = 0,25.
Решение: масса кислоты в растворе m = ρ×δ×V; 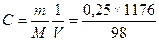
Задача. Какой объем раствора с ω = 9,3% серной кислоты с ρ = 1,05 (г/мл)
потребуется, чтобы приготовить 0,35М раствор кислоты объемом 40 мл.
Решение: Vωρ×ω = VCC×M; Vω = 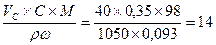 мл.
мл.
Задача. Сколько мл 0,1М раствора KMnO4 надо взять, чтобы приготовить
120 мл 0,02М раствор.
Решение: чтобы приготовить 120 мл 0,02М раствора, надо взять m = C×V×M граммов соли. В исходном растворе соли mо = Cо×Vо×M. По условию задачи
m = mо, следовательно C×V×M = Cо×Vо×M; 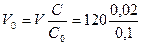 = 24 мл.
= 24 мл.
Для приготовления раствора надо взять 24 мл исходного раствора и
добавить 120 – 24 = 96 г воды.
2.2.5. Моляльная концентрация вещества в растворе Cm – это отношение
количества растворенного вещества в 1 кг растворителя: если n – число молей растворенного вещества, тогда 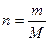 и
и 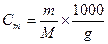 ; m – масса растворённого вещества в граммах, М – молярная масса растворенного вещества, g – масса растворителя в граммах. Если ρ – плотность растворителя, V – объем растворителя, тогда масса растворителя g =ρV и
; m – масса растворённого вещества в граммах, М – молярная масса растворенного вещества, g – масса растворителя в граммах. Если ρ – плотность растворителя, V – объем растворителя, тогда масса растворителя g =ρV и
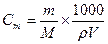 ; [ρ] = г/л, [V] = л., [m] = грамм.
; [ρ] = г/л, [V] = л., [m] = грамм.
2.2.6. Нормальная концентрация или нормальность раствора - это количество эквивалентов nэкв растворенного вещества в 1 литре раствора: Сн = nэкв/V; [V] = литр. Нормальная концентрация обозначается Сн или H. Запись 2H(H2SO4) означает раствор серной кислоты, в каждом литре которого содержится 2 молярных массы эквивалентов серной кислоты.
Так как количество эквивалентов растворенного вещества nэкв = m/Мэкв, m – масса растворенного вещества в граммах, Мэкв – молярная масса эквивалента растворенного вещества, [Мэкв] = г/моль, получим: нормальная концентрация вещества в растворе Cn = (m/Мэкв)/V
Замечание: параллельно с понятием молярная масса эквивалента вещества, используется понятие грамм – эквивалент вещества.
Эквивалентом называется весовое количество вещества, взаимодействующее без остатка с одной (точнее с 1,008) весовой частью водорода или с восемью частями кислорода. Эквивалент водорода равен 1, кислорода 8.
Вычисление молярной массы эквивалента вещества (Мэкв)
Молярная масса эквивалентов кислорода О2 Мэкв = 8, молярная масса эквивалентов водорода равна Мэкв = 1
Молярная масса эквивалентов иона равна атомной массе элемента деленной на заряд иона. Например, Мэкв(Ca2+) = 40/2 =20
Молярная масса эквивалентов элемента в составе гидрида равна молекулярной массе элемента деленной на число атомов водорода в химической формуле гидрида. Например, М экв (Cl) в HCl равна 34,5/1 = 34,5 г/моль, М экв (N) в NH3 равна 14/3, М экв (С) в СН4 равна 12/4 = 3
Молярная масса эквивалентов элемента в составе окисла равна молярной массе элемента деленной на степень окисления элемента в химической формуле окисла. Например, М экв (Cu) в Cu2O равна 63,5/1 = 64,5 г/моль, М экв (Cu) в CuO равна 63,5/2 = 31,75 г/моль.
Молярная масса эквивалентов окисла Мэкв = A/s + 8 A – атомный вес элемента в составе окисла, s – степень окисления элемента в окисле. Например, Мэкв(N2O) = 14/1 + 8 = 22(г/моль), Мэкв(N2O3) = 14/3 + 8 = 38/3 (г/моль), Мэкв(Fe2O3) = 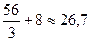 (г/моль); Мэкв(СО2) = 12/4 + 8 = 11(г/моль).
(г/моль); Мэкв(СО2) = 12/4 + 8 = 11(г/моль).
Молярная масса эквивалентов кислоты равна молярной массе кислоты, деленной на число атомов водорода, которые замещаются в данной реакции, на основность кислоты. Например, Мэкв серной кислоты в реакции H2SO4 + Zn = ZnSO4 + H2 равна 98/2 = 49(г/моль); Мэкв серной кислоты в реакции H2SO4 + NaCl = NaHSO4 + HCl равна 98/1 = 98(г/моль)[замещается только один атом водорода].
Молярная масса эквивалентов основания равна молярной массе основания, деленной на число гидроксильных групп: Мэкв (NaOH) = 40/1 = 40(г/моль).
Молярная масса эквивалентов соли равна молярной массе соли, деленной на произведение валентности металла в составе соли на число атомов металла в составе соли. Например: Мэкв (BaSO4) = 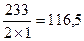 (г/моль), Мэкв (Al2(SO4)3) =
(г/моль), Мэкв (Al2(SO4)3) = 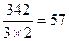 ; в 1Н растворе соли должно содержаться 57 г Al2(SO4)3 в одном литре раствора. В рассмотренных примерах мы считаем, что все атомы металла замещаются атомами водорода. Но это совсем необязательно. Например, молярная масса эквивалентов фосфата натрия Na3PO4 в реакции Na3PO4 + 2HCl = NaH2PO4 + 2NaCl М экв = 164/2, т.к. в реакции замещаются 2 атома натрия.
; в 1Н растворе соли должно содержаться 57 г Al2(SO4)3 в одном литре раствора. В рассмотренных примерах мы считаем, что все атомы металла замещаются атомами водорода. Но это совсем необязательно. Например, молярная масса эквивалентов фосфата натрия Na3PO4 в реакции Na3PO4 + 2HCl = NaH2PO4 + 2NaCl М экв = 164/2, т.к. в реакции замещаются 2 атома натрия.
В случае кристаллогидратов при расчете эквивалента соли следует учитывать кристаллизационную воду. Например, Мэкв (CaCl2•6H2O) =
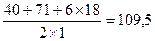 (г/моль) [валентность кальция 2, число атомов кальция 1].
(г/моль) [валентность кальция 2, число атомов кальция 1].
а) Закон эквивалентов утверждает, что массы вступивших в реакцию веществ
пропорциональны их эквивалентам, 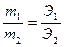 где m1, m2 и Э1 и Э2 – массы и
где m1, m2 и Э1 и Э2 – массы и
эквиваленты взаимодействующих веществ соответственно.
 2015-06-05
2015-06-05 1979
1979
