в) Закон эквивалентов можно записать по- другому: V1×H1 = V2×H2,
где V и Н – объём и нормальная концентрация реагентов.
Задача. При восстановлении водородом 0,646 г оксида металла образовалось
0,162 г воды. Записать химическую формулу оксида.
Решение: в 0,162 г воды кислорода содержится 0,144 г. Такое количество
кислорода потребовалось для образования 0,646 г оксида, следовательно,
металла в оксиде 0,646 – 0,144 = 0,502 г. Закон эквивалентов: 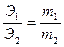 ,
,
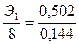 ; эквивалент металла в оксиде Э1 = 27,89. Это соответствует
; эквивалент металла в оксиде Э1 = 27,89. Это соответствует
химической формуле оксида FeO.
Пользуясь растворами, концентрация которых выражена нормальностьюН, легко рассчитать в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 литров раствора вещества 1 с концентрацией Н1 реагирует с V2 л раствора вещества 2 с концентрацией Н2. Чтобы вещества прореагировали без остатка, Н1×V1 = Н2×V2.
Задача: Определить концентрацию серной кислоты H2SO4, если для нейтрализации 60 мл кислоты потребовалось 20 мл 0,3Н раствора щелочи.
|
|
|
Решение: так как вещества реагируют в эквивалентных количествах, получим: Н1×60 = 0,3×20 Н1 = 0,1. Ответ: концентрация серной кислоты равна 0,1Н.
Задача. Вычислить молярную концентрацию раствора Cm, если к 1,5Н
раствору щелочи NaOH объемом 1,2 литра добавить 0,4 литра 0,6Н
раствора щелочи.
Решение: 1,5Н концентрация щелочи равна 1,5/1 = 1,5(моль/л), аналогично 0,6Н = 0,6М. Следовательно, 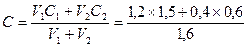 = 1,275 (моль/л).
= 1,275 (моль/л).
Задача. Вычислить нормальную, молярную и процентную концентрации
раствора, если в растворе объемом 400 мл растворили 10,4 г фосфата
кальция, Ca3(PO4)2, M(Ca3(PO4)2 = 310; плотность раствора ρ = 1,04(г/мл).
Решение: молярная масса эквивалентов соли Мэкв = 310/(2×3) ≈ 52
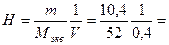 0,5(моль/л);
0,5(моль/л); 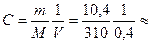 0,08 (моль/л)
0,08 (моль/л)
ω% = 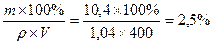 .
.
2.2.7. Концентрация, выражаемая титром. Титром называется число граммов растворенного вещества в 1 мл раствора; титр обозначается буквой Т; [Т] = г/мл; Т = m/V, m – масса растворенного вещества в граммах,
V – объем раствора в мл или см3.
Задача: определить моляльность, нормальность и титр 40% раствора
серной кислоты H2SO4, имеющей плотность ρ = 1,307 г/мл.
Решение: воспользуемся формулой для пересчета концентраций:
δ×ρ = С×М; 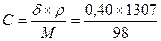 ; С = 5,33(моль/л). Для серной кислоты Н = 2С = 10,66 (моль/л). Титр – это число граммов кислоты в 1 мл; т.к. у нас кислоты 5,33 моля, а это 5,55×98 = 522,34 г в 1 литре; Т = 522,34/1000 = 0,52234 г/мл.
; С = 5,33(моль/л). Для серной кислоты Н = 2С = 10,66 (моль/л). Титр – это число граммов кислоты в 1 мл; т.к. у нас кислоты 5,33 моля, а это 5,55×98 = 522,34 г в 1 литре; Т = 522,34/1000 = 0,52234 г/мл.
 2015-06-05
2015-06-05 9347
9347
