Раствором называется однородная (гомогенная) система переменного состава. Под растворимостью понимают массу вещества, способной при данной температуре раствориться в 100 г растворителя. В зависимости от агрегатного состояния растворителя различают газофазные, жидкие и твердые растворы. В термодинамике различают растворы по степени межмолекулярного взаимодействия компонентов раствора. Термодинамическая классификация растворов: идеальные, разбавленные и реальные. В гидрогеохимии растворы различают по степени минерализации раствора. Минерализация раствора m(г/кг) - это суммарное масса растворенных веществ (в граммах) в одном килограмме воды. Установлена следующая классификация вод, см. таблицу:
| М (г/кг) | |
| Пресные воды Солоноватые воды Соленые воды Рассолы | до 1 от 1 до 25 от 25 до 50 более 50 |
Пресные воды и частично солоноватые можно отнести к разбавленным растворам, соленые воды - к реальным растворам. Природные растворы образуются в результате растворения в воде компонентов земной коры и газов. В гидрогеохимии для записи качественного и количественного состава раствора пользуются формулой Курлова (в виде дроби) В числители дроби указываются анионы, в знаменатели – катионы, входящие в состав раствора. Количественное содержание ионов дается в процентах от общего количества эквивалентов катионов и анионов.
Грамм - эквивалент иона рассчитывается как отношение молярной массы иона к его заряду, эквивалент равен отношению массы иона к г - экв. В формуле Курлова перед дробью записывается общая минерализация природного раствора в промилле. (промилле растворенного вещества – количество растворенного вещества в граммах на 1 кг воды).
Задача. Записать формулу Курлова для морской воды состава (в г/1кг воды)
| Катионы | Анионы | ||||||
| Na+ | Mg2+ | Ca2+ | K+ | Cl− | SO42− | HCO2− | CO32− |
| 10,78 | 1,30 | 0,41 | 0,39 | 19,35 | 2,70 | 0,14 | 0,07 |
Вычисляем г-экв катионов и анионов, количество их эквивалентов
(экв = г/г-экв) и процентное содержание эквивалентов.
Рассчитаем общую минерализацию морской воды в г/кг Н2О:
m = 12,86 + 22,26 = 35,12. Запишем формулу Курлова: 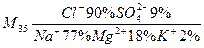 .
.
Хлорид натрия NaCl придаёт воде соленый вкус, сульфат магния MgSO4-
горький вкус.
| К а т и о н ы | ||||
| Компонент | грамм | г − экв | эквивалент | % экв |
| Na+ | 10,78 | 22,99 | 0,468 | 77,35 |
| Mg2+ | 1,30 | 12,15 | 0,107 | 17,69 |
| Ca2+ | 0,41 | 20,04 | 0,02 | 3,31 |
| K+ | 0,39 | 39,10 | 0,01 | 1,65 |
| Сумма | 12,86 | 0,605 | 100% |
| А н и о н ы | ||||
| Компонент | грамм | г − экв | эквивалент | % экв |
| Cl− | 19,35 | 35,45 | 0,546 | 90,08 |
| SO42− | 2,70 | 48,03 | 0,056 | 9,26 |
| HCO2− | 0,14 | 61,02 | 0,0023 | 0,33 |
| CO32− | 0,07 | 30,00 | 0,0023 | 0,33 |
| Сумма | 22,26 | 100% |
 2015-06-05
2015-06-05 1054
1054








