Задача. Вычислить рН раствора сильного электролита CsOH c молялярной концентрацией 0,05 М.
Решение: в воде сильный электролит диссоциирует необратимо:
CsOH = Cs+ + OH−. [Cs+] = [OH−] = 0,05M; т.к. [H+]×[OH−] = 10−14, следовательно lg[H+] + lg[OH−] = −14, lg[H+] = −14 – lg[OH−] = −14 – lg(0,05) = −14 – (−1,3) = −12,7. pH = −lg[H+] = 12,7. Раствор CsOH – щелочной.
Задача. Вычислить рН раствора слабого электролита СН3СООН (уксусная кислота) c моляльной концентрацией 0,1 М, если константа диссоциации
кислоты при 25оС равна 1,75×10−5.
Решение: запишем уравнение диссоциации кислоты: СН3СООН = СН3СОО− + Н+. Табличное значение константы диссоциации уксусной кислоты равна 1,75×10−5. Решение: 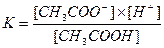 , К×[CH3COOH] = [CH3COO─]×[H+]
, К×[CH3COOH] = [CH3COO─]×[H+]
если [CH3COO−] = [H+] = x, тогда х2 = 1,75×10−5×0,1
x = [H+] ≈ 1,32×10−3; pH = − lg[H+] = 2,88.
Повторим, что кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода, Н+, и рН < 7.
Основания – это электролиты, которые при диссоциации образуют только один вид анионов: ОН─, и pH > 7.
Амфотерные гидроксиды [Be(OH)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3] - это слабые электролиты и при диссоциации образуют одновременно катионы водорода Н+ и гидроксид ионы ОН─. Например, химическую формулу гидроксида цинка можно записать и как Zn(OH)2, и так: H2ZnO2. При первой записи получим Zn(OH)2 = Zn2+ + 2OH─, при второй записи: H2ZnO2 = 2H+ + ZnO22─
Средние соли - сильные электролиты, которые диссоциируют на катион металла и анион кислотного осадка: Al2(SO4)3 = 2Al3+ + 3SO42─
Кислые соли – сильные электролиты, которые диссоциируют на катион металла и сложный анион: NaHCO3 = Na+ + HCO3─
Оснóвные соли – электролиты, которые при диссоциации образуют сложный катион и анион кислотного остатка: Fe(OH)2Cl = Fe(OH)2+ + Cl─.
 2015-06-05
2015-06-05 3741
3741








