В водных растворах электролиты могут полностью или частично распадаться на ионы. Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации: 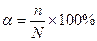 n – число молекул распавшихся на ионы, N – общее число растворенных молекул.
n – число молекул распавшихся на ионы, N – общее число растворенных молекул.
Электролиты, для которых α ≈ 100% называются сильныными электролитами(соли, кислоты HClO4, HNO3, HCl, H2SO4, щелочи NaOH, KOH).
Электролиты, для которых α < 3%, называют слабыми электролитами (HClO2, HNO2, H2SO3, H3PO4, H2S, Fe(OH)2, Cu(OH)2, NH4OH).
Для характеристики слабых электролитов применяют понятие константы диссоциации К. Константа диссоциации электролита и константа равновесия реакции - это одно и то же. Например, для реакции диссоциации уксусной кислоты СН3СООН = СН3СОО─ + Н+, 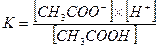 = 1,8×10─5. Как правило, константу диссоциации слабого электролита определяют экспериментально и она не зависит от концентрации электролита.
= 1,8×10─5. Как правило, константу диссоциации слабого электролита определяют экспериментально и она не зависит от концентрации электролита.
 2015-06-05
2015-06-05 469
469








