Молекулярная адсорбция – адсорбция на поверхности адсорбента молекул неэлектролитов и слабых электролитов.
Адсорбируемость веществ на границе раздела фаз А / С определяется правилом уравнивания полярностей П.А. Ребиндера: вещество В будет адсорбироваться на границе раздела фаз А / С, если оно будет уравнивать полярности этих фаз:
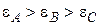 или
или 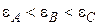 ,
,
где 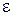 – полярность (диэлектрическая проницаемость) вещества.
– полярность (диэлектрическая проницаемость) вещества.
Таким образом, адсорбат (растворенное вещество) должен занимать промежуточное значение по полярности между полярностью адсорбента и полярностью растворителя. Это правило дает возможность правильно выбрать адсорбент, адсорбат и растворитель.
Например: на границе вода (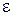 = 81) – уголь (
= 81) – уголь (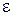 ≈ 1) адсорбироваться будут вещества, у которых
≈ 1) адсорбироваться будут вещества, у которых 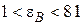 .
.
Для системы адсорбент – адсорбтив влияниеприроды растворителя на адсорбцию может быть сформулировано в виде правила Шилова: чем лучше растворяется адсорбтив в растворителе, тем он хуже адсорбируется поверхностью твердого адсорбента и наоборот, чем лучше растворяется, тем хуже адсорбируется.
Следовательно, малополярные адсорбенты (активированный уголь) лучше адсорбируют неполярные органические соединения, причем тем больше, чем выше их молярная масса. На поверхности полярных адсорбентов, являющихся оксидами (силикагель, алюмогель и др.), как правило, имеются гидроксильные группы, поэтому они хорошо сорбируют воду. Спирты, амины и другие полярные соединения.
Зависимость адсорбции от строения молекул адсорбата довольно сложна и вывести какие-либо общие количественные закономерности адсорбции практически не возможно. Молекулы ПАВ при адсорбции на поверхности твердого адсорбента ориентируются таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной.
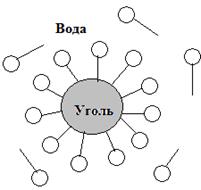 а а | 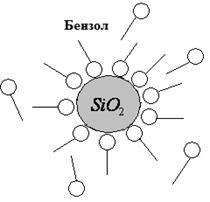 б б |
| Рис. 3.40. Ориентация дифильных молекул ПАВ на поверхности адсорбента: а – неполярный адсорбент в полярном растворителе; б – полярный адсорбент в неполярном растворителе |
Как известно, процесс адсорбции идет с выделением тепла, поэтому с повышением температуры молекулярная адсорбция часто уменьшается. С ростом концентрации раствора молекулярная адсорбция возрастает до какого-то предельного значения. Анализ экспериментальных изотерм адсорбции показывает, что молекулярная адсорбция может быть описана уравнениями Лэнгмюра и Фрейндлиха. В системе полярный растворитель – малополярный адсорбент адсорбция ПАВ подчиняется правилу Дюкло – Траубе.
Методы молекулярной адсорбции широко используют для глубокой очистки сточных вод от растворенных органических веществ (фенолов, гербицидов, пестицидов, ароматических нитросоединений, ПАВ, красителей и др.). Достоинством метода является высокая эффективность, возможность очистки сточных вод, содержащих несколько веществ, а также рекуперации этих веществ.
В качестве адсорбентов используют активные угли, синтетические сорбенты. Широкое использование активных углей в качестве сорбентов объясняется их слабым взаимодействием с молекулами воды и сильным взаимодействием с молекулами органических веществ. Скорость процесса адсорбции зависит от концентрации, природы и структуры растворенных веществ, температуры воды, вида и свойств адсорбента.
Например,адсорбционную очистку сточных вод от нитропродуктов, производят углями КАД. Уголь регенерируют растворителями (бензолом, этанолом, метиленхлоридом). Растворитель и нитропродукты разделяют перегонкой. Для извлечения фенолов из сточных вод используют активные угли марок ИГП-90, КАД, БАУ, АГ-3, АП-3. Степень извлечения фенолов этими углями изменяется от 50 до 99 %.
 2015-06-05
2015-06-05 9963
9963
