2. Электрический ток в жидкостях. Электролиз. Законы электролиза.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии.
Анодом при электролизе называется положительный электрод,
катодом — отрицательный.
Положительные ионы — катионы — движутся к катоду,
отрицательные ионы — анионы — движутся к аноду.
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=Ikt
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
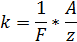
где 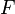 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
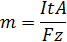
 2015-06-05
2015-06-05 948
948








