1. Реакция с участием FeCl3 протекает по уравнению: FeCl3 + 2NaOH = Fe(OH)2Cl + 2NaCl. Определить массу хлорида железа (III), содержащуюся в 200 см3 0,1 н раствора хлорида железа (III).

| РЕШЕНИЕ Молярную концентрацию эквивалентов FeCl3 определяем по формуле Сэк(FeCl3) = 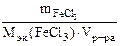 , моль/л откуда , моль/л откуда 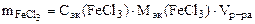 |
Мэк(FeCl3) = 
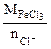 , г/моль
, г/моль
где 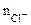 - число ионов Сl-, замещенных в данной реакции на ОН-;
- число ионов Сl-, замещенных в данной реакции на ОН-;
Мэк(FeCl3) -молярная масса эквивалентов хлорида железа (III), г/моль,
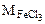 - молярная масса хлорида железа (III), г/моль
- молярная масса хлорида железа (III), г/моль
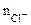 = 2, так как в данной реакции два иона хлора замещаются на 2 иона ОН-
= 2, так как в данной реакции два иона хлора замещаются на 2 иона ОН-
Тогда 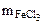 = 0,1· 200 · 10-3 · 81,25 = 1,625 г
= 0,1· 200 · 10-3 · 81,25 = 1,625 г
где Мэк(FeCl3) = 
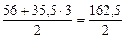 = 81,25 г/моль.
= 81,25 г/моль.
где 10-3 – пересчет см3 в л.
Ответ: 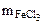 = 1,625 г.
= 1,625 г.
2. Сколько граммов хлорида магния потребуется для приготовления 800 см3 25%-ного водного раствора плотностью 1,2 г/см3?
Дано: 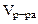 = 800 cм3 = 800 cм3 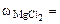 25% мас. 25% мас. 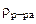 = 1,2 г/см3 = 1,2 г/см3 | РЕШЕНИЕ: Массовая доля MgCl2 равна: 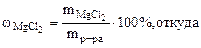 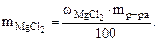 |
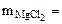 ? ? |
mр-ра = Vр-ра·ρр-ра = 800·1,2 = 960 г.
Откуда: 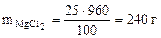
Ответ: 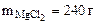
3. Определить массу сульфата меди (II), содержащуюся в 800 см3 0,3 М водного раствора сульфата меди (II).
Дано: Vр-ра = 800 см3 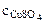 = 0,3 М = 0,3 М | РЕШЕНИЕ: Молярную концентрацию СuSO4 определяем по формуле: 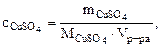 моль/л моль/л |
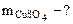 |
где:
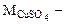 молярная масса сульфата меди (II), г/моль.
молярная масса сульфата меди (II), г/моль.
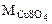 = 64 + 32 + 64 = 160 г/моль
= 64 + 32 + 64 = 160 г/моль
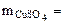
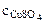 ·
· 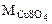 ·
· 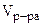 = 0,3·160·800·10-3 = 38,4 г
= 0,3·160·800·10-3 = 38,4 г
где 10-3 - пересчет см3 в л.
Ответ: 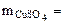 38,4 г.
38,4 г.
 2015-06-05
2015-06-05 1482
1482

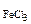 -?
-? 






