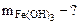| РЕШЕНИЕ: Мэк (FeCl3) = 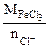 , г/моль , г/моль 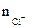 - число ионов хлора, замещенных в данной реакции на гидроксильную группу ОН-. По реакции а): - число ионов хлора, замещенных в данной реакции на гидроксильную группу ОН-. По реакции а): |
а) FeCl3 + NaOH = FeOHCl2 + NaCl
определяем 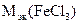 :
:
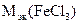 =
= 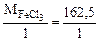 = 162,5 г/моль
= 162,5 г/моль
б) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
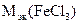 =
= 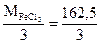 = 54,17 г/моль
= 54,17 г/моль
Ответ:а) 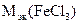 = 106,8 г/моль
= 106,8 г/моль
б) 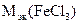 = 54,17 г/моль
= 54,17 г/моль
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать эквивалентные массы оксида и металла. Назвать этот металл.
 | РЕШЕНИЕ: По закону эквивалентов 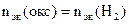 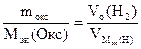 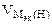 = 11,2 л/моль – эквивалентный объем водорода = 11,2 л/моль – эквивалентный объем водорода |
МЭК(Окс) = 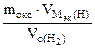 =
= 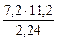 = 36 г/моль
= 36 г/моль
МЭК(Окс) = МЭК(Ме) + МЭК(О)
МЭК(Ме) = МЭК(Окс) – МЭК(О) = 36 - 8 = 28 г/моль
МЭ = МЭК(Ме) · В
Если В = 1 МЭ = 28 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2 МЭ = 56 г/моль. Следовательно, Ме - Fe
Ответ: Мэк(Окс) = 36 г/моль, Мэк(Ме) = 28 г/моль, Ме – Fe
3. Хлорид некоторого металла массой 0,493 г обработали избытком раствора AgNO3. При этом образовалось 0,86 г AgCl. Вычислить эквивалентную массу эквивалента металла и назвать этот металл.
 | РЕШЕНИЕ: По закону эквивалентов: 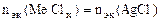 т.е. т.е. 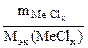 = = 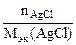 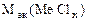 = = 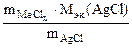 |
где х – валентность Ме, т.к. заряд хлорид иона равен – 1.
Мэк (AgCl) = 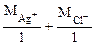 = 108 + 35,5 = 143,5 г/моль
= 108 + 35,5 = 143,5 г/моль
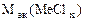 =
= 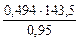 = 74,62 г/моль
= 74,62 г/моль
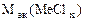 =
= 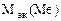 +
+ 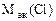
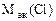
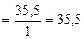 г/моль
г/моль
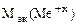 =
= 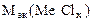 -
- 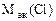
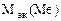 = 74,62 –35,5 = 39,12 г/моль.
= 74,62 –35,5 = 39,12 г/моль.
МЭ = 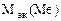 · В. Если х = В = 1, то МЭ = 39,12 г/моль, что соответствует молярной массе атома калия.
· В. Если х = В = 1, то МЭ = 39,12 г/моль, что соответствует молярной массе атома калия.
Ответ: 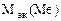 = 39,12 г/моль, Ме - К
= 39,12 г/моль, Ме - К
УРОВЕНЬ В
1. При растворении 16,25 г двухвалентного металла в кислоте выделилось 6,52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить эквивалентную массу металла и назвать металл. Давление паров воды при температуре 298К равно 23,76 мм рт. ст.
 | РЕШЕНИЕ: По закону эквивалентов 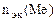 = = 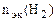 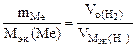 Мэк(Ме) = Мэк(Ме) = 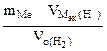 = = = = 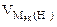 = 11,2 л/моль = 11,2 л/моль |
По объединенному уравнению газового состояния
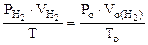
где: То = 273 К, Ро = 760 мм рт.ст.
Робщ = 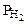 +
+ 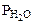 ;
; 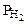 = Робщ -
= Робщ - 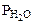
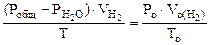
Определяем 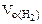
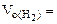
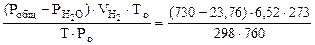 = 5,55л
= 5,55л
Мэк(Ме) = 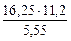 =32,79 г/моль
=32,79 г/моль
Мэк(Ме) = 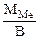 , г/моль, где В – валентность металла
, г/моль, где В – валентность металла
ММе = Мэк(Ме) ∙ В = 32,79 ∙ 2 = 65,58 г/моль, что соответствует молекулярной массе атома цинка.
Ответ: Мэк(Zn) = 32,79 г/моль, металл – Zn
2. При окислении металла израсходовано 3,79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39,43 г оксида. Определить эквивалентные массы эквивалентов металла и оксида. Назвать металл.
  | РЕШЕНИЕ: По закону эквивалентов nэк (окс) = nэк(О2) 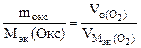 Мэк(Окс) = Мэк(Окс) = 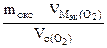 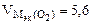 л/моль л/моль |
По объединенному уравнению газового состояния
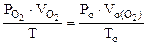
где: ТО = 273 К, РО = 760 мм рт.ст.
Определяем 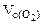
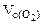 =
= 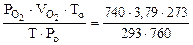 = 3,44 л.
= 3,44 л.
Мэк(Окс) = 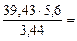 64,2 г/моль
64,2 г/моль
Мэк(Окс) = Мэк(Ме) + Мэк(О)
Мэк(Ме) = Мэк(Окс) - Мэк(О)
Мэк(Ме) = 64,2 – 8 = 56,2 г/моль
ММе = Мэк(Ме) ∙ В. Если В = 1, то МЭ = 56,2 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то ММе = 112,4 г/моль. Следовательно, металл - кадмий
Ответ: Мэк(Окс) = 64,2 г/моль
Мэк(Ме) = 56,2 г/моль
Ме – Cd
3. Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием:
а) хлорида дигидроксожелеза (III);
б) хлорида гидроксожелеза (III);
в) хлорида железа (III).
В каждой реакции вычислить эквивалентную массу гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3,65 г хлороводородной кислоты.

| РЕШЕНИЕ: Мэк (основ.) = 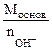 , г/моль , г/моль 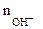 - число гидроксогрупп, замещенных в данной реакции на кислотный остаток. По реакциям а), б) и в): Определяем - число гидроксогрупп, замещенных в данной реакции на кислотный остаток. По реакциям а), б) и в): Определяем 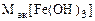 |
а) HCl + Fe(OH)3 = Fe(OH)2Cl + H2O
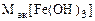 =
= 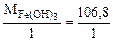 = 106,8 г/моль
= 106,8 г/моль
б) 2HCl + Fe(OH)3 = FeOHCl2 + 2H2O
Mэк[Fe(OH)3] = 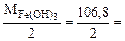 53,4 г/моль
53,4 г/моль
в) 3HCl + Fe(OH)3 = FeCl3 + 3H2O
Mэк[Fe(OH)3] = 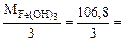 35,6 г/моль.
35,6 г/моль.
По закону эквивалентов:
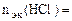
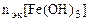 , т.е.
, т.е. 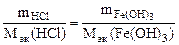
Откуда по реакции (в)

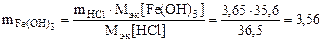 г,
г,
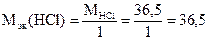 г/моль
г/моль
где Mэк[Fe(OH)3] = 35,6 г,моль
Ответ:а)Mэк[Fe(OH)3] = 106,8 г/моль
б) Mэк[Fe(OH)3] = 53,4 г/моль
в) Mэк[Fe(OH)3] = 35,6 г/моль.
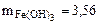 г.
г.
 3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
 2015-06-05
2015-06-05 7361
7361

 2,24 л Мэк(Окс.) -? Мэк(Ме) -? Ме -?
2,24 л Мэк(Окс.) -? Мэк(Ме) -? Ме -? 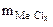 = 0,494г
= 0,494г 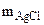 = 0,95 г Mэк(Me) -? Me -?
= 0,95 г Mэк(Me) -? Me -? 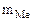 =16,25 г В = 2
=16,25 г В = 2 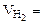 6,52 л Т = 298 К Робщ = 730 мм рт.ст
6,52 л Т = 298 К Робщ = 730 мм рт.ст 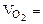 3,79 л Т = 293 К
3,79 л Т = 293 К 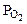 = 740 мм рт.ст. Мэк(Окс) -? Мэк(Ме) -? Ме -?
= 740 мм рт.ст. Мэк(Окс) -? Мэк(Ме) -? Ме -? 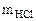 = 3,65 г Fe(OH)3 Mэк[Fe(OH)3] -?
= 3,65 г Fe(OH)3 Mэк[Fe(OH)3] -?