|
РЕШЕНИЕ:
FeCl3 диссоциирует в растворе:
FeCl3 → Fe3+ + 3Cl-
 Fe Cl3
Fe Cl3
Fe (OH)3 + H2SO4
cлаб. cильн.
Сокращенное ионно-молекулярное уравнение гидролиза:
|
|
Fe3+ + НОН <=> +, рН<7, среда
кислая
Молекулярное уравнение гидролиза:
FeCl3 + H2O <=> FeOHCl2 + HCl

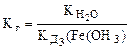 ,
,
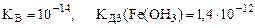 (табл.)
(табл.)
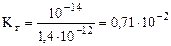
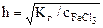 ;
; 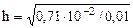 =0,84
=0,84
pН= -1/2∙lgKг-1/2∙lg 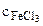 =
=
= 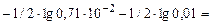
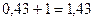

Ответ: 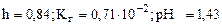
2. Используя справочные данные по 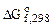 и
и 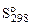 веществ определить равновесное парциальное давление СО при температуре 1000 К для реакции:
веществ определить равновесное парциальное давление СО при температуре 1000 К для реакции:
Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).
 | РЕШЕНИЕ: Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г). 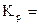 р р 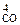 |
-2,3RTlgKp = 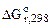 – T
– T 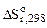
Значения 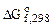 и
и 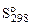 веществ берем из табл.
веществ берем из табл.
| Fe3O4(к)+ | 4C(к) = | 3Fe(к) + | 4CO(г) | |
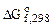 , кДж/моль , кДж/моль | -1117,1 | 4(-110,5) | ||
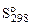 , Дж/моль·К , Дж/моль·К | 146,2 | 4·5,7 | 3·27,15 | 4·197,5 |
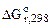 =[4
=[4 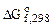 (CO(г)) + 3
(CO(г)) + 3 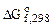 (Fe(к))]-
(Fe(к))]-
-[ 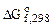 (Fe3O4(к)) + 4
(Fe3O4(к)) + 4 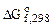 (C(к))]
(C(к))]
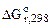 = 4(-110,5) – (-1117,1) = 675,1 кДж.
= 4(-110,5) – (-1117,1) = 675,1 кДж.
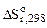 = [4
= [4 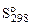 (CO(г)) + 3
(CO(г)) + 3 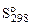 (Fe(к))] –
(Fe(к))] –
-[ 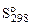 (Fe3O4(к))+ 4
(Fe3O4(к))+ 4 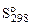 (C(к))]
(C(к))]
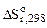 = [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К
= [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К
Kp = 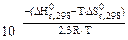
Kp = 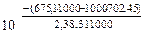 = 26,9
= 26,9
р 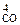 = 26,9
= 26,9
рCO = 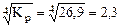 атм.
атм.
Ответ: рCO = 2,3 атм.
3. При растворении 6 г сплава меди, железа и алюминия в хлороводородной кислоте выделилось 3 л водорода (н.у.) и получено 1,86 г нерастворившегося осадка (н.о.). Определить состав сплава (%мас.).
|
|
|
|
РЕШЕНИЕ:
ωме = 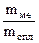 ∙ 100%
∙ 100%
 |
В хлороводородной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
Fe + 2HCl = FeCl2 + H2 (17.4)
2Al + 6HCl = 2AlCl3 + 3H2 (17.5)
Медь в этих условиях не растворяется, следовательно:
mн.о. = mCu = 1,86 г
mFe+Al = mспл – mCu= 6 – 1,86 = 4,14 г
Пусть х – масса железа в сплаве, г;
Fe - H2 (реакция 17.4)
56 г Fe - 22,4 л Н2
m г Fe - V 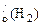
V 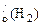 =
= 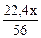 , л
, л
Тогда (4,14 – х) - масса алюминия в сплаве, г;
2 Al → 3H2 (реакция 17.5)
2∙27 г Al - 3·22,4 л Н2
(4,14 – х) г Al - V 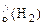
V 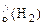 =
= 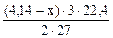 , л
, л
Суммарный объем выделившегося водорода:
V 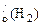 + V
+ V 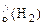 =
= 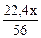 +
+ 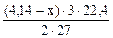 = 3 л
= 3 л
m = 2,56 г
Следовательно 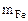 = 2,56 г,
= 2,56 г, 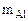 = 4,14 – 2,56 = 1,58 г
= 4,14 – 2,56 = 1,58 г
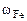 =
= 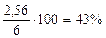
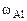 =
= 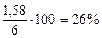
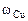 =
= 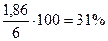
Ответ: состав сплава: 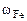 = 43%мас.,
= 43%мас., 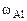 = 26%мас.,
= 26%мас.,
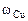 = 31%мас.
= 31%мас.
 2015-06-05
2015-06-05 4066
4066

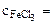 0.01M Kг -? pH-? h -?
0.01M Kг -? pH-? h -? 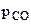 -?
-? 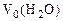 = 3 л mн.о.=1,86 г %ωFe -? %ωAl -? %ωCu -?
= 3 л mн.о.=1,86 г %ωFe -? %ωAl -? %ωCu -?