1. Растворы электролитов. Сильные и слабые электролиты. Удельная и эквивалентная электропроводность. Числа переноса.
2. Закон разведения Оствальда, Закон Кольрауша. Кондуктометрическое титрование.
3. Электродные процессы, гальванические элементы. Возникновение электродного потенциала на границе раздела двух фаз.
4. Уравнение Нернста, индикаторные электроды, электроды сравнения.
5. Термодинамика гальванического элемента. Электрометрическое определение рН растворов.
Электролитами называют вещества, которые при взаимодействии с растворителем подвергаются диссоциации на ионы и сообщают раствору способность проводить электрический ток.
Из опыта известно, что все растворы электролитов обнаруживают отклонения от законов разбавленных растворов, касающиеся давления насыщенного пара, осмотического давления, температур кристаллизации и кипения.
Отношение повышения температуры кипения электролита и неэлектролита при одинаковых условиях и одинаковых концентрациях растворов обычно значительно больше 1, так же больше 1 и отношение понижения давления насыщенного пара, температуры кристаллизации и осмотического давления растворов электролитов и неэлектролитов.
Все формулы, относящиеся к этим явлениям, по предложению Вант-Гоффа должны быть уточнены путем введения предложенного им изотонического коэффициента, который учитывает увеличение соответствующих эффектов по сравнению с растворами неэлектролитов.
(Отношение экспериментально определенного осмотического давления к рассчитанному по закону Вант-Гоффа называется изотоническим коэффициентом:
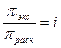 )
)
Изотонический коэффициент показывает, во сколько раз возрастает концентрация ионов за счет диссоциации электролита.
Поэтому определив коэффициент i по какому либо другому свойству (например, по осмосу) и ΔТ криоскопическим методом, можно рассчитать истинную молярную массу электролита:
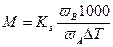 i
i
Перечисленные особенности растворов электролитов, обнаружение ионов путем спектрального анализа и другие экспериментальные факты привели к появлению во второй половине Х1Х в. теории электролитической диссоциации, которая была предложена С. Аррениусом в 1883г. и явилась первой научно обоснованной теорией электролитов.
В соответствии с ней, при образовании раствора электролита происходит диссоциация растворенного вещества на ионы, и тем более полная, чем больше разбавлен раствор электролита.
Несмотря на упрощенность этой теории, не рассматривающей причин диссоциации, не учитывающей сил взаимодействия между частицами, Образования сольватов и других явлений, она позволила объяснить целый ряд фактов.
Для количественной оценки полноты диссоциации была принята величина α:
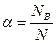
названная степенью диссоциации.
Изучение степени диссоциации дало возможность разделить все электролиты на две группы: слабые и сильные электролиты.
Диссоциация слабых электролитов идет не до конца и в растворах таких электролитов устанавливается равновесие двух процессов: диссоциация молекул а ионы и рекомбинация противоположно заряженных ионов в нейтральные молекулы. При разбавлении раствора и уменьшении концентрации слабого электролита встреча ионов, необходимая для рекомбинации, становится все менее вероятной, что приводит к росту степени диссоциации и обращении ее при бесконечном разбавлении в единицу. Силами взаимодействия между ионами слабых электролитов можно пренебречь.
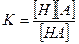 | 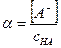 | 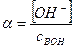 | 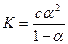 |
Тогда константа равновесия для раствора электролита запишется как:
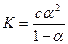 которое называется законом разведения Оствальда. При небольших значениях α можно считать, что 1- α =1 и тогда
которое называется законом разведения Оствальда. При небольших значениях α можно считать, что 1- α =1 и тогда
α=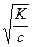 т.е. для того, чтобы увеличить К (а значит, и электропроводность) в 10 раз, раствор нужно разбавить в 100 раз.
т.е. для того, чтобы увеличить К (а значит, и электропроводность) в 10 раз, раствор нужно разбавить в 100 раз.
При использовании закона Оствальда была изучена степень диссоциации слабых электролитов в широких пределах. Однако дальнейшее изучение показало, что теория Аррениуса имеет ограниченное применение.
Другую группу составляют сильные электролиты.
Экспериментальное определение степени диссоциации таких электролитов дает неоднозначны величины. Закон действующих масс для таких электролитов не применим.
Теория электролитической диссоциации сильных электролитов была создана Дебаем и Гюккелем в 1923г.
Эта теория ввела понятие ионной атмосферы. Центральный ион притягивает к себе ионы противоположного знака и отталкивает одноименные ионы. Поэтому около центрального иона противоположно заряженные ионы будут находиться дольше. В результате вблизи центрального иона возникает избыточный заряд противоположного знака, величина которого убывает с удалением от центрального иона.
Вокруг положительного иона создается избыточная отрицательная ионная атмосфера, а каждый отрицательный ион окружен положительной ионной атмосферой. Ввиду того, что в целом электролит незаряжен, суммарный заряд всегда равен, но противоположен по знаку заряду центрального иона.
Характер распределения заряда в ионной атмосфере зависит от сил межионного взаимодействия, обеспечивающее образование ионной атмосферы, и от интенсивности теплового движения, стремящегося разрушить ее и привести к хаотическому распределению ионов.
Предположение об электростатическом взаимодействии ионов объясняет отличие растворов сильных электролитов от идеальных. Вычисляя работу образования ионной атмосферы, можно количественно оценить степень отклонения от идеального состояния и найти коэффициент активности электролита.
Коэффициент активности электролита показывает меру отклонения свойств реального раствора от свойств идеального, находящегося в стандартном состоянии. В результате получается уравнение предельного закона Дебая-Гюккеля, справедливое для сильно разбавленных бинарных растворов электролитов:
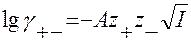
где – средний коэффициент эл-та, заряды ионов, ионная сила раствора, А – коэф-т, зависящий от температуры и диэлектр. проницаемостью.
Ионы взаимодействуют не только друг с другом, но и с молекулами растоврителя. Храрктер этих взаимодействий различен и зависит от типа ионов и природы сил, действующих между ними(короткодействующих и дальнодействующих). Взаимодействие между частицами в растворе за счет короткодействующих сил могут быть сильными и слабыми.
Сильные химические взаимодействия наблюдаются между ионами и молекулами растворителя и сопровождаются обобществлением электронов. Примерами могут служить взаимодействия ионов Н и Н2О, ионом металла и воды, приводящие к образованию иона гидроксония Н
3о.
Слабые химические взаимодействия наблюдаются между молекулами и ионами, при это6м образуются комплексы типа НА….А.
Под сольватацией (гидратацией) понимают совокупность энергетических и структурных явлений, происходящих в растворе при взаимодействии частиц растворенного вещества с молекулами растворителя.
Термодинамическая устойчивость сольватов определяется величиной энергии Гиббса (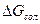 ).
).
Так как 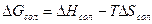 то чем меньше
то чем меньше 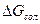 , тем устойчивее комплекс. Основной вклад в величину
, тем устойчивее комплекс. Основной вклад в величину 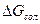 вносит энтальпия сольватации
вносит энтальпия сольватации 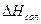 , которую находят из соотношения
, которую находят из соотношения
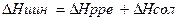
где 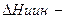 первая интегральная теплота растворения вещества в данном растворителе, энергия кристаллической решетки растворенного вещества, а энтальпия сольватации измеряется калориметром.
первая интегральная теплота растворения вещества в данном растворителе, энергия кристаллической решетки растворенного вещества, а энтальпия сольватации измеряется калориметром.
Электрическая проводимость электролитов
Закон Кольрауша, кондуктометрическое титрование.
Все электролиты являются проводниками второго рода. В растворах сольватированнные ионы находятся в беспорядочном движении, но при наложении внешнего электрического поля они начинают двигаться в направлении противоположно заряженных электродов.
Скорость движения иона в электрическом поле определяется произведением заряда иона на градиент потенциала поля, и фактором сопротивления среды R, зависящим от температуры, природы иона и растворителя:
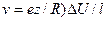 гле е – элементарный электрический заряд, z –заряд иона, dU – разность потенциалов между электродами, д – расстояние междуэлектродами.
гле е – элементарный электрический заряд, z –заряд иона, dU – разность потенциалов между электродами, д – расстояние междуэлектродами.
Сравнение скоростей движения различных ионов проводят при градиенте поля 1 В/м.
При этом расстояние в метрах, которое проходит ион за 1 сек при градиенте поля в 1 В/м, называют абсолютной скоростью иона, или его подвижностью, обозначают u и измеряют в м2/В*сек:
u= ez|R
Известно, что R=ρ (l/S), если в закон Ома I=U/R подставим это значение, то после преобразования получим:
I=US/(ρl), и если площадь –1м2, расстояние между электродами – 1м, напряжение – 1В, то:
I=1/ρ=χ где χ- удельная электропроводность.
Физический смысл удельной электропроводности заключается в том, что она численно равна силе тока, создаваемого ионами, имеющимися в 1 м3 раствора через площадку в 1м2 при напряжении поля в 1В.
Величины тока, создаваемого катионами и анионами в 1 м3 соответственно равны:
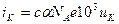 и
и 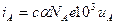 , суммарный ток равен сумме токов:
, суммарный ток равен сумме токов:
I=i+i=χ= 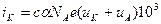 а так как Nae=F, то
а так как Nae=F, то
χ=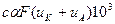 где Fu =λ - ионные эквивалентные электрические проводимости, или ионные подвижности. Тогда:
где Fu =λ - ионные эквивалентные электрические проводимости, или ионные подвижности. Тогда:
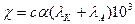
Зависимость удельной электропроводности электролита от концентрации у сильных и слабых изображена на графике.
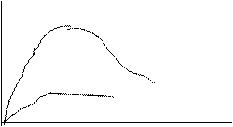 |
У сильных – одновременно с ростом концентрации увеличивается и взаимное притяжение ионов, что приводит к уменьшению скорости. При определенном значении концентрации уменьшение скорости начинает преобладать над влиянием увеличивающейся концентрации и электропроводность падает.
У слабых – концентрация ионов мала, силы электростатич. взаимодействия незначительны, скорость движения ионов практически не зависит от концентрации, и проводимость определяется фактически произведением 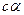 .
.
 2014-02-09
2014-02-09 2682
2682
