Большинство ферментов катализирует реакции, в которых участвует более одного субстрата. В случае если кофермент не является простетической группой, его можно рассматривать как косубстрат или другими словами как второй субстрат. Следовательно, участников ферментативной реакции может быть несколько: собственно фермент, несколько субстратов и кофермент.
В случаях бисубстратных реакций механизм ферментативного катализа, как правило, может идти по одному из двух путей: по механизму «пинг-понг» (механизм двойного замещения) или последовательному механизму.
Механизм «пинг-понг» схематично может быть представлен следующим образом:
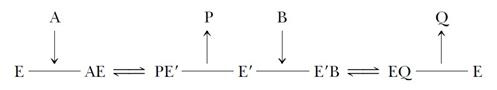
Связывание субстрата А с ферментом (Е) приводит к образованию фермент-субстратного комплекса ЕА, при этом субстрат А превращается в продукт (Р), который покидает фермент. В результате такого преобразования фермент остается в изменённой (Е')форме, в результате модификации кофермента. Далее в активном центре фермента происходит связывание субстрата В с образованием второго фермент-субстратного комплекса Е'В, последующим превращением субстрата В в продукт Q и высвобождением нативной формы фермента (Е).
Примером этого механизма являются реакции дегидрирования с участием коферментов FAD и FMN.
Последовательный механизм ферментативной бисубстратной реакции предусматривает взаимодействие с ферментом двух субстратов до их превращения в соответствующие продукты. В этом случае связывание субстратов возможно различными путями – упорядоченным или случайным способом.
Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
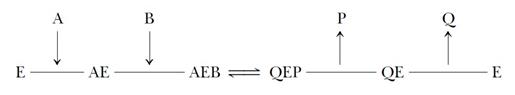
Первым в активный центр фермента доставляется субстрат А,облегчая тем самым присоединение субстрата В.
После химического превращения этих субстратов так же в определённом порядке происходит высвобождение продуктов реакции (Р и Q). Примером такого механизма является реакция дегидрирования с участием коферментов NAD + и NADP +.
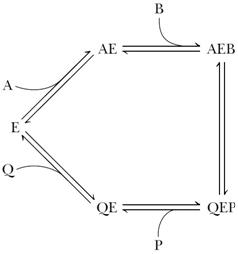
Механизм случайного взаимодействия субстрата с активным центром фермента:
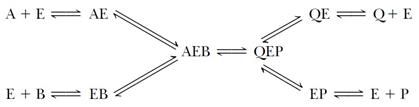
Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет, так как каждый субстрат имеет свой центр связывания. Также нет строгой закономерности высвобождения продуктов реакции.
 2015-06-26
2015-06-26 1237
1237








