Головна відмінність квантової теорії від класичної лежить в припущенні дискретності станів різних фізичних систем. Істотно, що при тих умовах, коли вказана дискретність станів сглажена, там виникає співпадання висновків обох теорій.
Наприклад, спектральні закономірності атомів при великих значеннях головного квантового числа п однаково можна описати як квантовою так і класичною теорією.
Класичні представлення виникли при описі різноманітних закономірностей в макросистемах, де дискретність практично не проявляється. Наприклад, різниця моментів кількості руху в суміжних квантових станах рівна 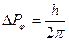 , а сам момент кількості руху макроскопічного тіла
, а сам момент кількості руху макроскопічного тіла 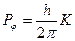 .
.
В мікросистемах різниця значень величини в сусідніх квантових станах майже рівні самим величинам, тому дискретність їх, незважаючи мала в макросистемах, і дуже суттєва в мікросистемах.
Таким чином,квантова теорія Бора не відхиляє закономірності старої класичної теорії, але уточнює їх, враховуючи дискретність станів.
Положення про включення старої теорії в нову, про перехід некласичної теорії в граничному випадку в класичну, становить зміст принципу відповідності теорій, які заміняють одна одну.
Переваги теорії Бора:
1. Показала непридатність класичних законів для пояснення фізичних процесів мікросвіту, де головну роль відіграють квантові закони.
2. Стимулювала розвиток експериментальних робіт в області фізики атома.
3. Створила основи нової спеціальності в фізиці – атомної спектроскопії.
Недоліки теорії Бора:
1. Теорії Бора властива внутрішня протиричивість. Вона є не поступово класичною, і не поступово квантовою теорією.
2. Навіть для найпростіших атомів теорія давала розподіл частот, але не інтенсивностей.
3. Повна невдача при спробі скласти теорію наступного за атомом водню – атома гелію.
4. Неможливість пояснення хвильових властивостей часток.
В даний час теорія Бора має евристичне значення і є перехідним етапом для створення послідовної теорії атомних явищ.
2.1.Атомний за лишок, поляризуємість багатоелектронних атомів
 Розрахунок енергетичних рівней атома з великою кількістю електронів представляє собою дуже складну задачу, яка вирішується наближенно методами квантової механіки. З точки зору квантової теорії побудова спектра гелія вже являється задачею без розв’язку, так як і для класичної механіки. Однак є група елементів, спектроскопічні властивості яких пояснюються напівкількісно в рамках теорії Бора-Зоммерфельда. Це відноситься до елементів Li (Z=3); Na (Z=11); K (Z=19); Rb (Z=37); Cs (Z=55). Чим характерні ці атоми, - вони складаються з ядер з зарядом +Ze, групи із (Z-1) електронів, які рухаються відносно близько до ядра і одного електрона, який рухається поза цієї групи. Наприклад, Li, ядро і група (Z-1) електронів утворює компактну систему з загальним зарядом +е - “атомний залишок” - аналогічно протону у водня. “Зовнішній” електрон рухається в полі атомного залишку подібно до атому водню. При великих n, поле залишка майже Кулонівське і для далеких орбіт значення енергій атомів лужних металів подібні до водню:
Розрахунок енергетичних рівней атома з великою кількістю електронів представляє собою дуже складну задачу, яка вирішується наближенно методами квантової механіки. З точки зору квантової теорії побудова спектра гелія вже являється задачею без розв’язку, так як і для класичної механіки. Однак є група елементів, спектроскопічні властивості яких пояснюються напівкількісно в рамках теорії Бора-Зоммерфельда. Це відноситься до елементів Li (Z=3); Na (Z=11); K (Z=19); Rb (Z=37); Cs (Z=55). Чим характерні ці атоми, - вони складаються з ядер з зарядом +Ze, групи із (Z-1) електронів, які рухаються відносно близько до ядра і одного електрона, який рухається поза цієї групи. Наприклад, Li, ядро і група (Z-1) електронів утворює компактну систему з загальним зарядом +е - “атомний залишок” - аналогічно протону у водня. “Зовнішній” електрон рухається в полі атомного залишку подібно до атому водню. При великих n, поле залишка майже Кулонівське і для далеких орбіт значення енергій атомів лужних металів подібні до водню:
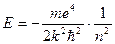 , (3.1)
, (3.1)
тобто рівні будуть воднеподібними і виродженими по азімутальному квантовому числу. Для орбіт близьких до атомного залишку, поле буде відрізнятися від Кулонівського. Причини:
1) Зовнішній електрон, знаходячись на відстані r від атомного залишку своїм кулонівським полем 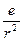 викликає поляризацію атомного залишкуі створює у нього електричний дипольний момент
викликає поляризацію атомного залишкуі створює у нього електричний дипольний момент
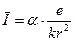 ,
,
де 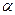 - поляризуємість. Напрямок
- поляризуємість. Напрямок 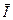 буде завжди співпадати з миттєвим значенням радіус вектора електрон-атомного залишка, тобто переважного напрямку не буде.
буде завжди співпадати з миттєвим значенням радіус вектора електрон-атомного залишка, тобто переважного напрямку не буде.
Потенціальна енергія електрона 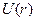 буде складатися з потенціальної енергії
буде складатися з потенціальної енергії 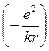 в Кулонівському полі залишка і потенціальної енергії
в Кулонівському полі залишка і потенціальної енергії 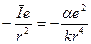 в полі дипольного моменту атомного залишка
в полі дипольного моменту атомного залишка
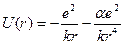 . (3.2)
. (3.2)
Це означає, що силове поле в якому рухається електрон, вже не чисто Кулонівське.
2) Друга причина полягає в проникненні окремих ділянок траекторії руху електрона в середину атомного залишку.Таким чином ці причини приводять до пониження енергетичних рівнів спектрів лужних металів відносно рівнів водня, тоді вираз для енергії можна записати
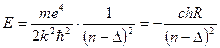 , (3.3)
, (3.3)
де R – постійна Рідберга; с – Швидкість світла; n – головне квантове число.
Для кожного значення k, буде своя поправка Δ(s, p, d, f…), яка зменшується з збільшенням k і яку з загальному випадку позначають Δ. Наприклад для атома Na при k=4 ® Δ=0; k=3® Δ=0,01; k=2® Δ=0,86; k=1® Δ=1,35. 
Тоді згідно комбінаційного принципу в спектрах атомів лужних металів будуть спостерігатися лінії різних серій з хвильовими числами
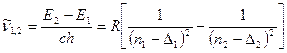 , (3.4)
, (3.4)
Причому в (3.4) можливі тільки комбінації переходів при Δk=±1.
Тоді в спектрі можна виділити чотири серії, з врахуванням, що для лужних металів (Na, K) основний стан для зовнішнього електрона 3S.
1. Головна (від латинського “principale” - головна) серія з хвильовими числами, які відповідають переходам: 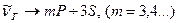 .
.
2. Різка (“sharp” - різка) серія: 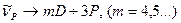 .
.
3. Дифузна (“diffuse” - розмита) серія: 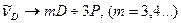 .
.
4. Основна (“fundamental” - основна або фундаментальна): 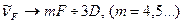 .
.
Детальне експериментальне дослідження спектрів атомів лужних металів показує наявність дублетної структури у ліній головної і різкої серій і триплетної - у дифузної і основної. Таку структуру спектрів можна пояснити, якщо припустити наявність двох близьких енергетчних рівнів у кожного з P, D, F-рівней, а S-рівні залишити одиночними. Це означає, що введена поправка Δ в (3.4) для кожного випадка p, d, f … повинна приймати два близьких значення.
 2015-06-28
2015-06-28 2280
2280
