При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида.
Решение.
Чтобы определить, какой металл был сожжен, рассчитаем молярную массу его эквивалента по закону эквивалентов:
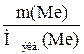 =
= 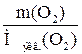 , Мэкв.(Ме)=
, Мэкв.(Ме)= 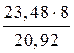 = 9 г/моль.
= 9 г/моль.
Молярная масса эквивалента кислорода равна 8 г/моль, а массу соединившегося с металлом кислорода определяем из соотношения:
m(Me2O3) = m(Me) + m(O2), m(O2) = 44,40 – 23,48 = 20,92 г.
Из формулы A(Me) = Мэкв.(Me) · n рассчитываем атомную массу металла:
AMe= 9 · 3 = 27 г.
По Периодической системе Д. И. Менделеева определяем, что металл с атомной массой 27 – алюминий. Формула оксида алюминия Al2O3. Его молярная масса эквивалента:
Мэкв.(Al2O3) = Мэкв.(Al) + Мэкв.(O2);
Мэкв.(Al2O3) = 9 + 8 = 17 г/моль.
 2015-06-24
2015-06-24 1593
1593
