Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
1. H2SO4 + 2NaOH = Na2SO4 + 2H2O.
2. 2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
3. Al(OH)3 + 3NaCl = AlCl3 + 3NaOH.
4. Zn(OH)2 + NaCl = ZnOHCl + NaOH.
Решение.
Решение. Молярные массы эквивалентов сложных веществ могут иметь различные значения (в зависимости от реакции, в которую они вступают).
Молярная масса эквивалента кислоты (гидроксида) равна ее молекулярной массе, деленной на количество атомов водорода (для гидроксида на количество OH- групп), замещенных в данной реакции другими атомами или ионами.
В первой реакции в молекуле серной кислоты 2 атома водорода замещаются на металл, во второй – 1 атом водорода фосфорной кислоты замещается на металл, поэтому
Мэкв.(H2SO4) = 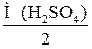 =
= 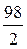 ,
,
Мэкв.(H2SO4) = 49 г/моль.
Мэкв.(Н3PO4) = 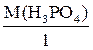 =
= 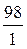 ,
,
Мэкв.(H3PO4) = 98 г/моль.
Соответственно в 3-й и 4-й реакциях в гидроксидах замещаются на хлорид- ионы три и одна гидроксогруппы соответственно, и их молярные массы эквивалентов равны:
Мэкв.[Al(OH)3] = 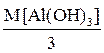 =
= 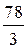 = 26 г/моль,
= 26 г/моль,
Мэкв.[Zn(OH)2] = 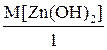 =
= 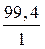 = 99,4 г/моль.
= 99,4 г/моль.
 2015-06-24
2015-06-24 1906
1906