 Второе начало т/д определяет условия, при которых возможны превращения энергии, т.е. определяет возможные направления процессов, происходящих в природе.
Второе начало т/д определяет условия, при которых возможны превращения энергии, т.е. определяет возможные направления процессов, происходящих в природе.
Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
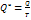 отношение теплоты, полученной в изотермическом процессе, к температуре тела – приведённое количество теплоты.
отношение теплоты, полученной в изотермическом процессе, к температуре тела – приведённое количество теплоты.
На бесконечно малом участке:
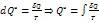
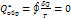
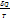 - полный дифференциал
- полный дифференциал
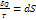 , где S – энтропия
, где S – энтропия
S – функция состояния системы, дифференциал которой 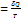 , - энтропия.
, - энтропия.
S – аддитивная величина
Энтропия замкнутой системы может либо возрастать, либо оставаться неизменной.
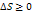
∆S=0 для обратимых процессов
∆S>0 для необратимых процессов
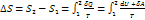
 2015-06-24
2015-06-24 442
442








