Самый распространенный жидкий растворитель – вода. Она обладает наиболее растворяющей и диссоциирующей способностью. Для воды температура растворения ограничивается интервалом 0–1000С.
Большинство растворяющихся в воде веществ являются твердыми.
Процесс растворения вещества сопровождается диффузией, т.е. перемещением молекул из областей более концентрированного раствора в области с меньшей его концентрацией. Другими словами, вещество при растворении равномерно распределяется по всей массе растворителя.
Процесс растворения происходит до тех пор, пока концентрация данного вещества в растворе не доходит до определенного значения, при котором наступает состояние равновесия:
MR ↔ MR
твердая фаза раствор
Способность твердого вещества переходить в раствор не беспредельна. При введении в стакан с водой (Т= const) первые порции вещества полностью растворяются, и образуется ненасыщенный раствор. В этом растворе возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор и часть его останется в виде осадка на дне стакана.
Растворение является двунаправленным процессом: твердое вещество переходит в раствор, а растворенное вещество в свою очередь переходит в твердую фазу. Если количество вещества, переходящего в раствор за единицу времени, равно количеству вещества, выделяющегося за то же время в твердую фазу, то это значит, что произошло насыщение раствора. Образующийся при этом раствор называется насыщенным раствором. Увеличение концентрации раствора замедляет установление равновесия.
Между веществом в насыщенном растворе и веществом в осадке устанавливается состояние гетерогенного равновесия. Частицы растворенного вещества переходят через поверхность раздела их жидкой фазы (раствора) в твердую фазу (осадок) и обратно, поэтому состав насыщенного раствора остается постоянным при некоторой фиксированной температуре. Насыщенные растворы являются стабильными системами, т. е. они могут существовать при данной температуре без изменения концентрации сколь угодно долго.
С изменением температуры изменяется и концентрация насыщенного раствора. При понижении температуры раствор может в определенных условиях некоторое время сохранять данную концентрацию вещества, т. е. концентрация раствора может оказаться выше, чем в насыщенном растворе при данной температуре. Такие растворы называют пересыщенными. Пересыщенные растворы являются нестабильными системами. Достаточно перемешать такой раствор или бросить самый маленький кристаллик растворенного вещества (затравку), чтобы начала выделяться твердая фаза. Этот процесс продолжается до тех пор, пока концентрация вещества не достигнет концентрации насыщенного раствора при данной температуре. Возможность существования пересыщенного раствора объясняется трудностью возникновения центров кристаллизации.
В растворах электролитов непрерывно происходят процессы ионизации и ассоциации. При этом поддерживается равновесие, сохраняется постоянным состав раствора, но процесс электролитической диссоциации не прекращается. Если же в раствор ввести некоторое другое вещество, то его ионы могут вступить в реакцию с первым веществом и образовать новое вещество, которое не вводилось в раствор. Например, в отдельно приготовленных растворах хлорида бария и сульфата натрия устанавливается равновесие:
в первом растворе: ВаС12 ↔ Ва2+ + 2С1-,
во втором растворе: Na2SО4 ↔ 2Na+ + SO42-.
Оба эти соединения представляют собой соли и относятся к сильным электролитам, т. е. в разбавленных растворах эти вещества находятся преимущественно в виде ионов. Если слить эти два раствора, то ионы SО42- встретятся не только с ионами натрия, но и с ионами бария и вступят с ними в реакцию:
SO42- + Ba2+ ↔ BaSО4.
Эта реакция происходит, так как сульфат бария является малорастворимым соединением и выпадает в осадок. В растворе останутся катионы натрия и анионы хлора,- но осадка не образуется, потому что хлорид натрия хорошо растворим в воде.
Процесс осаждения происходит постепенно. Сначала образуются очень мелкие кристаллы - зародыши, которые постепенно вырастают в кристаллы большого размера или группу кристаллов. Время с момента смешивания растворов до образования зародышей — мелких кристаллов называют индукционным периодом. Продолжительность этого периода зависит от индивидуальных свойств осадка. Так, в случае образования хлорида серебра это время очень мало, в случае образования сульфата бария этот период значительно больше.
Осаждение в химическом анализе следует проводить так, чтобы образовывалось по возможности меньшее количество мелких кристаллов (зародышей), тогда при постепенном прибавлении осадителя будут нарастать имеющиеся центры кристаллизации, т. е. будут расти крупные кристаллы.
Растворимость вещества – качественная и количественная способность вещества образовывать раствор при смешивании с другим веществом (растворителем).
Растворимость веществ определяется концентрацией насыщенного при данной температуре раствора.
Состав насыщенного раствора может быть выражен любым известным способом (массовая доля, молярная концентрация и др.). Чаще других величин применяют коэффициент растворимости ks - отношение массы безводного растворенного вещества к массе растворителя, например, при 200С коэффициент растворимости равен 0,316 для KNО3, что соответствует 24,012%-ному или 2,759М раствору.
Растворимость часто выражают количеством граммов растворяемого вещества в 100г растворителя.
ПРИМЕР 2.1 Вычислите коэффициент растворимости ВаС12 в воде при 00С, если при этой температуре в 13,1г раствора содержится 3,1г ВаС12.
Решение. Коэффициент растворимости выражают массой вещества (г), которое можно растворить в 100г растворителя при данной температуре. Масса раствора ВаС12 13,1г. Следовательно, в 10г растворителя при 00С содержится 3,1г ВаС12. Коэффициент растворимости ВаС12 при 00С равен:
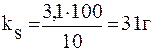
В случае растворения твердых или жидких веществ в жидкостях растворимость возрастает с повышением температуры, а для газов – убывает. На растворимость газов большое влияние оказывает давление.
По растворимости при Т = const различают:
1) хорошо растворимые вещества (образуют >0,1М насыщенные растворы),
2) малорастворимые вещества (образуют 0,1 - 0,001М насыщенные растворы),
3) практически нерастворимые вещества (образуют <0,001М насыщенные растворы).
Например, MgCl2 - хорошо растворимое в воде вещество (при 200С образует 5,75М насыщенный раствор), MgCО3 - малорастворимое вещество (образует 0,02М раствор) и Mg(OH)2 - практически нерастворимое вещество (образует 1,2∙10-4М раствор).
Растворимость вещества зависит от его природы и агрегатного состояния до растворения, а также от природы растворителя и температуры приготовления раствора, а для газов также и от давления.
 2015-06-24
2015-06-24 5232
5232
