Раствором называют гомогенную систему, состоящую из двух или большего числа компонентов. При переходе вещества в раствор происходит разрыв межмолекулярных и ионных связей кристаллической решетки твердого вещества и переход его в раствор в виде отдельных молекул или ионов, которые равномерно распределяются среди молекул растворителя.
Для разрушения кристаллической решетки вещества необходимо затратить большую энергию. Эта энергия освобождается в результате гидратации (сольватации) ионов и молекул, т. е. химического взаимодействия растворяемого вещества с водой (или вообще с растворителем).
Значит, растворимость вещества зависит от разности величин энергии гидратации (сольватации) и энергии кристаллической решетки вещества.
Энергия растворения ?Нраст - энергия, поглощающаяся (или выделяющаяся) при растворении 1 моль вещества в таком объеме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта.
Общий тепловой эффект растворения зависит от тепловых эффектов:
· а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии?Н1>0);
· б) диффузии растворенного вещества в растворителе (затрата энергии?Н2>0);
· в) сольватации (гидратации) (выделение теплоты,?Н3<0, так как между растворителем и растворенным веществом образуются непрочные химические связи, что всегда сопровождается выделением энергии).
Общий тепловой эффект растворения?Нp будет равен сумме названных тепловых эффектов
Энергия растворения определяется по формуле 1.1:
?Нpacт =?Нкp. р. +?Нc, (1.1)
где?Нраст - энергия растворения вещества, кДж/моль;
?Нc - энергия взаимодействия растворителя с растворяемым веществом (энергия сольватации), кДж/моль;
?Нкp.р. - энергия разрушения кристаллической решетки, кДж/моль.
Если энергия разрушения кристаллической решетки больше энергии сольватации, то процесс растворения будет эндотермическим процессом, поскольку энергия, затраченная на разрушение кристаллической структуры, не будет скомпенсирована энергией, выделяющейся при сольватации.
Если энергия разрушения кристаллической решетки меньше энергии сольватации, то процесс растворения будет экзотермическим процессом, поскольку энергия затраченная на разрушение кристаллической структуры полностью скомпенсирована энергией, выделяющейся при сольватации. Следовательно, в зависимости от соотношения между энергией разрушения кристаллической решетки растворенного вещества и энергией взаимодействия растворенного вещества с растворителем (сольватация) энергия растворения может быть как положительной, так и отрицательной величиной.
Так, при растворении в воде хлорида натрия температура практически не изменяется, при растворении нитрата калия или аммония температура резко снижается, а при растворении гидроксида калия или серной кислоты температура раствора резко повышается.
Растворение твердых веществ в воде чаще бывает процессом эндотермическим, так как во многих случаях при гидратации выделяется теплоты меньше, чем тратится на разрушение кристаллической решетки.
Энергию кристаллической решетки можно рассчитать теоретически. Однако для теоретического расчета энергии сольватации до сих пор нет надежных методов.
Существуют некоторые закономерности, которые связывают растворимость веществ с их составом.
Для солей одного и того же аниона с разными катионами (или наоборот) растворимость будет наименьшей в том случае, когда соль образована ионами одинакового заряда и примерно одинакового размера, т.к. в этом случае энергия ионной кристаллической решетки максимальна.
Например, растворимость сульфатов элементов второй группы периодической системы уменьшается по подгруппе сверху вниз (от магния к барию). Это объясняется тем, что ионы бария и сульфата по размерам больше всего подходят друг к другу. В то время как катионы кальция и магния намного меньше анионов SO42-.
Растворимость гидроксидов этих элементов, наоборот, увеличивается от магнию к бария, потому что радиусы катионов магния и анионов гидроксида практически одинаковые, а катионы бария по размеру очень отличаются от небольших анионов гидроксила.
Однако бывают исключения, например, для оксалатов и карбонатов кальция, стронция, бария и др.
Энергию растворения можно рассчитать:
1) используя изменение температуры при растворении.
Количество энергии, выделяющейся при нагревании или охлаждении тела рассчитывается по уравнению (1.2):
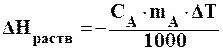 , (1.2)
, (1.2)
где?Нраств. – энергия растворения вещества, кДж/моль;
сА - удельная теплоемкость вещества А, Дж/(г?К);
m1 - масса вещества А, г;
?Т – изменение температуры, град.
ПРИМЕР 1.1 При растворении 8г хлорида аммония в 291г воды температура понизилась на 20. Вычислите теплоту растворения NH4C1 в воде, принимая удельную теплоемкость полученного раствора равной теплоемкости воды 4,1870 Дж/(г * К).
Решение:
Используя уравнение (1.2), рассчитаем энергию, поглощаемую 291 г воды при растворении 8г NH4C1, т.к. при этом температура уменьшается на 20С, то:?Нраств.= -(4,187?291?(-2)) = 2436,8 Дж.
Для определения энтальпии растворения NH4C1 составляем пропорцию, М (NH4C1)=53,49 г/моль:
8г NH4Cl — 2436,8 Дж
53,49г NH4C1 — х Дж
х = 1629,3Дж = 16,3кДж. Следовательно, растворение NH4C1 сопровождается поглощением тепла.
2) используя следствие из закона Гесса: тепловой эффект химической реакции (ΔН0х.р.) равен сумме теплот (энтальпий) образования продуктов реакции (ΔH0o6р..npoд.) минус сумма теплот (энтальпий) образования исходных веществ (ΔН0обр.исх.) с учётом коэффициентов перед формулами этих веществ в уравнении реакции.
ΔН0х.р. = ΣΔН0 обр.прод - Σ ΔН0обр.исх , (1.3)
ПРИМЕР 1.2 Рассчитайте тепловой эффект реакции растворения алюминия в разбавленной соляной кислоте, если стандартные теплоты образования реагирующих веществ равны (кДж/моль):?Н0(НС1) {aq} = - 167,5;?Н0А1С13{аq}= -672,3.
Решение: Реакция растворения А1 в соляной кислоте протекает по уравнению 2А1+6НС1(aq)=2AlCl3(aq)+3H2. Поскольку алюминий и водород являются простыми веществами, то для них ΔН0=0 кДж/моль, то тепловой эффект реакции растворения равен:
?Н0298=2??Н0А1С13{аq}-6??Н0НС1{aq}
?Н0298=2?(-672,3)-6?(-167,56)=-339,2кДж.
Используя следствие из закона Гесса можно определить возможность протекания реакции растворения. В этом случае необходимо рассчитать энергию Гиббса.
ПРИМЕР 1.3 Будет ли растворяться сульфид меди в разбавленной серной кислоте, если энергия Гиббса реагирующих веществ равна (кДж/моль):?G0(CuS(к))= -48,95;?G0(H2SО4(aq))=-742,5;?G0(CuSО4(aq))= -677,5,?G0(Н2S(г)) = -33,02.
Решение. Для ответа необходимо подсчитать?G0298 реакции растворения. Возможная реакция растворения CuS в разбавленной H2SO4 протекает по уравнению:
CuS (к) + H2SО4 (aq) = CuSО4 (aq) + H2S (г)
?G0298 =?G0(CuSО4(aq)) +?G0(Н2S(г)) -?G0(CuS(K)) -?G0(H2SО4(aq))
?G0298 = -677,5-33,02 + 742,5 + 48,95 =80,93 кДж/моль.
Так как?G>0, реакция невозможна, т. е. CuS не будет растворяться в разбавленной H2SO4.
Зная энергию растворения можно рассчитать энергию присоединения кристаллизационной воды (энергию гидратации).
Теплота гидратации?Н0гидрат. - теплота, выделяемая при взаимодействии 1 моль растворяемого вещества с растворителем - водой.
ПРИМЕР 1.4. При растворении 52,06г ВаС12 в 400 моль Н2О выделяется 2,16 кДж теплоты, а при растворении 1 моль ВаС12?2Н2О в 400 моль Н2О поглощается 18,49 кДж теплоты. Вычислите теплоту гидратации безводного ВаС12,
Решение. Процесс растворения безводного ВаС12 можно представить следующим образом:
а) гидратация безводной соли ВаС12
ВаС12+2Н2О = ВаС12?2Н2О;?Нгидр.<0
б) растворение образовавшегося гидрата
BaCl2?2H2О+aq* → ВаС12?2Н2О (aq);?Нраст.>0
Количество теплоты?Н0, выделяющееся при растворении безводного ВаС12, равно алгебраической сумме тепловых эффектов этих двух процессов:
?Н0 ==?Н0гидр+?Н0раств;?Н0гидр =?Н0 -?Н0раств
Для вычисления теплоты гидратации безводного хлорида бария надо определить теплоту растворения ВаС12 для тех же условий, что и для ВаС12?2Н2О, т. е. для 1 моль ВаС12 (раствор в обоих случаях должен иметь одинаковую концентрацию); M(BaCl2)=208,25 г/моль
52,06г ВаС12 - 2,16кДж
208,25г ВаС12 - х кДж
х=8,64 кДж/моль. Следовательно,?Нраств=-8,64 кДж/моль.
Тогда?Нгидр=18,49+8,64 =27,13 кДж/моль.
 2015-06-24
2015-06-24 24454
24454
