Образование твердой фазы (кристаллизация) - сложный процесс, состоящий из нескольких стадий.
1. Дегидратация ионов, образующих осадок. Ионы в растворе гидратированы, твердая фаза во многих случаях не содержит воды, поэтому ионы перед образованием кристалла должны утратить гидратную воду.
2. Образование первичных центров кристаллизации. Два иона противоположного знака, объединяясь в молекулу, не образуют еще кристаллической формы. Образование первичного кристаллика проходит через ряд промежуточных стадий. Так, при осаждении сульфата бария из пересыщенных растворов происходят такие процессы:
Ва2+ + SO42-↔ Ba2+SО42- — образование ионной пары;
Ba2+SО42- + SО42- (или Ва2+)↔Ba(SО4)22- [или Ba2(SО4)2+];
Ba(SО4)22- + Ва2+↔(Ba2+SО42-)2;
(Ba2+SО42-)2+SO42- (или Ва2+)↔Ва2 (SО4)32- [или Ba3(SО4)22+];
Ba2(SО4)32- + Ba2+↔(Ba2+SО42-)3 и т. д.
Это так называемый индукционный период.
Таким образом, для образования первичного кристаллика в какой-либо точке раствора должны объединяться между собой по крайней мере по несколько ионов противоположного знака. Только в этом случае может образоваться первичный кристаллик (зародыш), например, кубической формы.
3. Рост первичных центров кристаллизации за счет осаждения на них все большего количества ионов, в результате чего образуются кристаллы большего размера, объединяющиеся между собой в более крупные агрегаты, не способные, однако, еще выделиться из раствора в виде осадка. Это — коллоидная стадия образования нерастворимого соединения.
4. Образование в течение некоторого времени в растворе настолько крупных кристаллов или их агрегатов, что они не могут более удерживаться в растворе, и, наконец, происходит выделение твердой фазы (осадка).
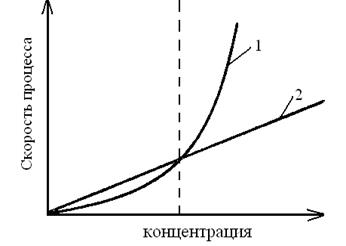
Рис. 3.1. Зависимость скоростей образования зародышей (1)
и их роста (2) от относительного пересыщения
Образовавшиеся осадки могут отличаться по своим свойствам. В одних случаях выделяются аморфные осадки, в других – кристаллические.
Характер осадка зависит от соотношения скоростей двух процессов: скорости образования зародышей - первичных центров кристаллизации υ1 и скорости роста размеров зародышей υ2. Значения υ1 и υ2 определяются относительным пересыщением, возникающим при добавлении раствора осадителя.
Мерой пересыщения раствора является степень пересыщения R, которая определяется выражением:
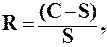 (3.1)
(3.1)
где С- концентрация осаждаемого вещества, которая получается при внесении осадителя;
S – равновесная растворимость осадка в данных условиях
Обычно при малых значениях относительного пересыщения υ2 > υ1 при его возрастании скорости обоих процессов становятся в некоторый момент времени равными, и, наконец, скорость υ1 начинает преобладать, т. е. υ2 становится меньше υ1.
На рис. 3.1 видно, что при малых значениях относительного пересыщения (левая часть рисунка) преобладает скорость роста зародышей, а при больших значениях (правая часть рисунка) преобладает скорость образования новых зародышей.
Рассмотренные зависимости объясняют, почему в одних случаях образуются аморфные, а в других - кристаллические осадки.
При добавлении раствора осадителя в первый момент времени образуется пересыщенный раствор труднорастворимого вещества. Если вещество мало растворимо, то достигается большое относительное пересыщение и скорость образования зародышей значительно больше, чем скорость их роста. В этих условиях при добавлении последующих порций раствора осадителя образуется большое количество новых центров кристаллизации. Эти первичные зародыши слипаются в более крупные агрегаты и выделяются из раствора в виде аморфного осадка.
Наоборот, если растворимость вещества не очень мала, относительное пересыщение меньше, чем в первом случае, и после прибавления раствора осадителя образуется сравнительно мало зародышей, размеры которых быстро увеличиваются. Из раствора выделяются отдельные кристаллы довольно значительных размеров - образуется кристаллический осадок.
Аморфные осадки состоят из множества слабо связанных между собой очень мелких кристалликов. Большинство таких осадков имеют кристаллическую структуру, вследствие чего их называет также скрытокристаллическими.
Степень пересыщения раствора можно изменять, регулируя условия осаждения.
Крупнокристаллический осадок имеет преимущества перед мелкокристаллическим и особенно аморфным осадком. Условия его осаждения можно определить, исходя из величины степени пересыщения раствора: чтобы осадок образовался кристаллический, необходимо уменьшить степень пересыщения R.
Согласно формуле (3.1) для уменьшения R необходимо уменьшить концентрацию осаждаемого вещества (С) и увеличить его растворимость (S).
Уменьшение концентрации осаждаемого соединения можно добиться:
1) разбавлением раствора;
2) понижением концентрации осадителя (метод «возникающего реагента»): в раствор вводят вещество, которое при соответствующей реакции, обычно идущей с малой скоростью, выделяет в раствор необходимый осадитель.
Увеличение растворимости осадка в процессе осаждения достигают повышением температуры или добавлением электролитов, которые повышают солевой эффект.
Наиболее существенной характеристикой аморфных осадков является очень большая общая поверхность. В связи с этим на поверхности аморфных осадков часто адсорбируются посторонние вещества. Кроме того, в связи с наличием большого количества очень мелких агрегатов, которые слабо связаны между собой, при промывании аморфные осадки могут образовывать коллоидные растворы.
 2015-06-24
2015-06-24 2763
2763
