Сильные электролиты, присутствующие в растворе, обычно повышают растворимость соприкасающихся с ним осадков. Например, растворимость PbSО4 в присутствии KNО3, NaNO3 и т. п. повышается и притом тем сильнее, чем больше общая концентрация всех подобных солей в растворе. Это явление, называемое солевым эффектом.
Произведение растворимости только в первом приближении можно рассматривать как произведение концентраций ионов в насыщенном растворе. В действительности же постоянным является не оно, а произведение активностей ионов в насыщенном растворе.
Например, действительные концентрации ионов Н+ и С1- в 0,1М растворе НС1, которая, как сильный электролит считается диссоциированной в водных растворах почти нацело, равны также по 0,1моль/л. Однако действуют эти ионы при различных химических реакциях так, как если бы их концентрация равнялась всего 0,0814 моль/л.
Концентрацию для сильных электролитов вычисляют, исходя из допущения почти полной диссоциации их в растворе. Что же касается коэффициента активности, то, согласно современной теории сильных электролитов, он представляет собой меру влияния электростатических сил притяжения и отталкивания, действующих между ионами на способность иона к химическим действиям.
Если fa < 1, это значит, что и он стеснен в своих движениях междуионными силами. В таком случае а < С, т. е. данное количество ионов (С, моль/л) действует так, как если бы их было меньше (а, моль/л). Если fa = 1, то а = С. Это значит, что ион действует соответственно своей «концентрации» в растворе. У сильных электролитов это происходит только в очень разбавленных растворах (С≤0,0001М), где расстояния между ионами настолько велики, что действующие между ними силы практически не играют роли. Аналогично же можно не считаться с междуионными силами и в случае не слишком концентрированных растворов слабых электролитов, у которых только ничтожная часть всех молекул диссоциирована на ионы. Для таких растворов можно принять, что fa =1 и а=С.
ПРИМЕР 3.5 Вычислить растворимость BaSO4 в 0,01М растворе Na2SО4 и сопоставить её с растворимостью этой соли в воде. ПР BaSO4=1,1·10-10.
Решение: Обозначим растворимость сульфата бария через х.
х моль BaSО4 дадут по х моль Ва2+ и SO42- соответственно. Но SO42-ионы образуются также в результате диссоциации Na2SО4. Учитывая, что каждый моль соли дадут 1 моль SO42-, можно написать:
[Ва2+]= х [SO42- ]=0,01+ х.
Подставив эти значения в уравнение произведения растворимости, получим: ПР= х ·(х + 0.01)= 1,1·10-10.
Если учесть, что растворимость BaSО4 очень мала, величиной по сравнению с 0,01 можно пренебречь. Сделав это, получим:
х ·0,01= 1,1·10-10 х = 1,1·10-8 моль/л.
Растворимость BaSO4 в воде равна у:
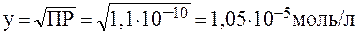
Таким образом, присутствие 0,01 моль/л Na2SO4 должно понизить растворимость BaSО4 в:
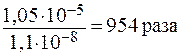
 2015-06-24
2015-06-24 7041
7041








