ГЛАВА 1. ЗАКОНОМЕРНОСТИ ОТЛОЖЕНИЯ ПРИМЕСИ В
ПАРОВЫХ КОТЛАХ
При контакте водного теплоносителя с поверхностью оборудования блока происходит отложение примеси на этой поверхности за счет кристаллизации, адсорбции, электростатического взаимодействия, механического зацепления, капиллярного эффекта и т.д. Количество и состав отложений зависит от концентрации и вида примеси, температуры поверхности и теплоносителя, теплового потока и т. д.
Одним из главных механизмов образования отложений является кристаллизация примеси на поверхности из раствора.
Кристаллизация веществ из раствора
Процесс кристаллизации состоит из двух стадий: образование центров кристаллизации (зародышей) и рост кристаллов (зародышей).
Центрами кристаллизации могут служить не только самопроизвольно образовавшиеся частицы самого вещества, но и любые другие частицы, способные адсорбировать на своей поверхности молекулы или ионы кристаллизующегося вещества. Такого типа центры всегда присутствуют на поверхности труб и в объеме водного теплоносителя. Поэтому первая стадия кристаллизации в реальных условиях не лимитирует скорость всего процесса.
Рост кристаллов определяется двумя процессами: диффузией строительных частиц к поверхности кристалла и введение их в определенные места кристалла.
Рассмотрим изменение концентрации примеси вблизи поверхности кристалла (рис. 1.1).
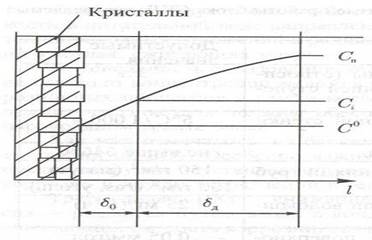
Рис. 1.1. Изменение концентрации примеси около поверхности кристалла в процессе кристаллизации вещества из раствора.
На поверхности кристалла концентрация примеси соответствует растворимости вещества С0 при температуре в данной точке (на поверхности кристалла, трубы и т. д.).
Около кристалла находится поверхностный слой жидкости, толщиной 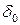 , в пределах которого действуют силы ван-дер-ваальсовского, электростатического взаимодействия между молекулами твердой фазы и жидкости. Этот слой жидкости практически неподвижен.
, в пределах которого действуют силы ван-дер-ваальсовского, электростатического взаимодействия между молекулами твердой фазы и жидкости. Этот слой жидкости практически неподвижен.
Поверхностный слой жидкости контактирует с диффузионным пристенным слоем толщиной 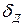 , в котором перемещение примеси (в молекулярной или дисперсной форме) происходит за счет диффузии под воздействием градиента концентрации (точнее – градиента химического потенциала). На границе этих слоев концентрация примеси
, в котором перемещение примеси (в молекулярной или дисперсной форме) происходит за счет диффузии под воздействием градиента концентрации (точнее – градиента химического потенциала). На границе этих слоев концентрация примеси 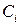 . Дальше располагается ядро потока (в двухслойной модели пристенного слоя) с концентрацией примеси
. Дальше располагается ядро потока (в двухслойной модели пристенного слоя) с концентрацией примеси 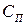 .
.
Интенсивность доставки вещества через диффузионный слой к поверхности кристалла 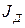
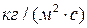 , рассчитывается по уравнению Фика:
, рассчитывается по уравнению Фика:
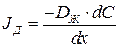 (1.1)
(1.1)
где 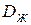 - коэффициент диффузии, рассчитанный по средней температуре жидкости в диффузионном слое.
- коэффициент диффузии, рассчитанный по средней температуре жидкости в диффузионном слое.
Принимая, что изменение концентрации примеси в диффузионном слое близко к линейному, преобразуем (1.1):
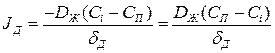 (1.2)
(1.2)
Процесс кристаллизации вещества можно разделить следующие этапы (рис.1.2): адсорбция частицы поверхностью, миграция ее в поверхностном слое жидкости к свободному месту в кристаллической решетке, внедрение в кристаллическую решетку. Этот процесс обычно описывается уравнением химической реакции первой степени
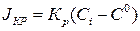 (1.3)
(1.3)
где 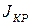 - скорость роста кристалла,
- скорость роста кристалла, 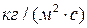
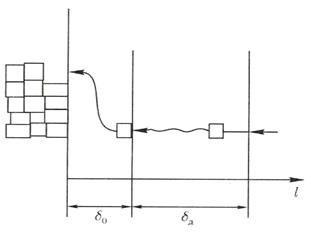
Рис. 1.2. Схема процесса собственно кристаллизации вещества.
Константа скорости реакции зависит от вещества, коэффициента диффузии частицы в поверхностном слое 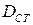 (по температуре стенки), кристаллической решетки, дефектов в ней и т.д.
(по температуре стенки), кристаллической решетки, дефектов в ней и т.д.
В стационарном режиме 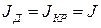 . Результирующий поток будет равен
. Результирующий поток будет равен
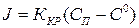 (1.4)
(1.4)
где 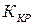 - коэффициент скорости кристаллизации.
- коэффициент скорости кристаллизации.
Исключим из (1.2) и (1.3) концентрацию 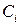 :
:
из (1.2): 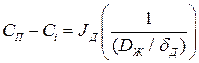
из (1.3): 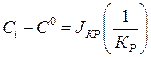
После сложения:
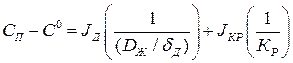
или
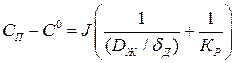 .
.
Сопоставление полученного выражения с (1.4) показывает, что
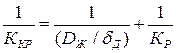 (1.5)
(1.5)
Отсюда коэффициент скорости кристаллизации будет равен
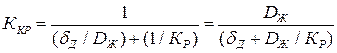 (1.6)
(1.6)
Коэффициент скорости кристаллизации определяется скоростью доставки примеси к месту кристаллизации и скоростью самого процесса кристаллизации.
Если скорость доставки значительно меньше скорости реакции 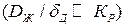 , то
, то 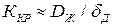 , т.е. весь процесс кристаллизации контролируется доставкой вещества. Наоборот, при
, т.е. весь процесс кристаллизации контролируется доставкой вещества. Наоборот, при 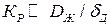 коэффициент
коэффициент 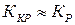 . Следовательно, процесс кристаллизации какого-либо вещества из раствора на твердой поверхности определяется стадией, идущей с наименьшей скоростью.
. Следовательно, процесс кристаллизации какого-либо вещества из раствора на твердой поверхности определяется стадией, идущей с наименьшей скоростью.
Введем понятие пересыщения раствора 
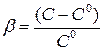 (1.7)
(1.7)
Тогда скорость кристаллизации
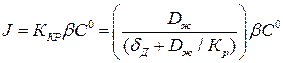 (1.8)
(1.8)
При больших пересыщениях скорость кристаллизации высока и лимитирующей стадией становится диффузия вещества к поверхности кристалла. Доставка вещества к кристаллу ограничивает скорость его роста и при высоких температурах, так как с увеличением температуры 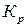 растет. Для водных растворов солей и некоторых веществ органического происхождения диффузия контролирует рост кристаллов при температуре выше 45-50°С.
растет. Для водных растворов солей и некоторых веществ органического происхождения диффузия контролирует рост кристаллов при температуре выше 45-50°С.
С уменьшением пересыщения роль процесса кристаллизации возрастает. Рост кристаллов происходит и при очень маленьких пересыщениях. Этот процесс связан с наличием дефектов в структуре и дислокациями в растущем кристалле. К дефектам относятся трещины, изломы, шероховатости поверхности. При пересыщении порядка 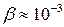 и выше скорость роста кристаллов может быть представлена в виде зависимости
и выше скорость роста кристаллов может быть представлена в виде зависимости
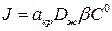 (1.9)
(1.9)
где 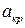 характеризует опорные размеры кристалла.
характеризует опорные размеры кристалла.
Как видно из анализа процесса кристаллизации, в доставке вещества и собственно кристаллизации существенную роль играют диффузионные процессы. При 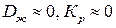 , кристаллизация вещества происходить не будет. Если же
, кристаллизация вещества происходить не будет. Если же 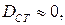 то
то 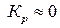 т. е. при наличии примеси около поверхности твердой фазы сам процесс кристаллизации не происходит.
т. е. при наличии примеси около поверхности твердой фазы сам процесс кристаллизации не происходит.
Рассмотрим когда возможны эти случаи в паровых котлах?
При сверхкритическом давлении в зоне максимальной теплоемкости
(рис. 1.3) происходит резкое снижение коэффициента диффузии вещества в водном теплоносителе. Это связано с коренной перестройкой структуры воды, когда подвижность ее молекул и коэффициент самодиффузии воды резко снижаются.
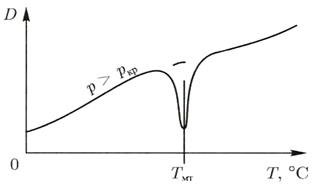
Рис.1.3. Зависимость коэффициента диффузии вещества в водном теплоносителе при сверхкритическом давлении от температуры.
Рассмотрим изменение температуры водного теплоносителя при сверхкритическом давлении по длине обогреваемой трубы в какой-то момент времени. На рис. 1.4. показано, что в сечении 1-1 температура воды становится равной температуре максимальной теплоемкости  у поверхности трубы, а затем, по мере прогрева среды, зона с
у поверхности трубы, а затем, по мере прогрева среды, зона с 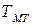 проникает все дальше по сечению трубы, пока ядро потока (в сечении 2-2) не прогреется до этой температуры.
проникает все дальше по сечению трубы, пока ядро потока (в сечении 2-2) не прогреется до этой температуры.
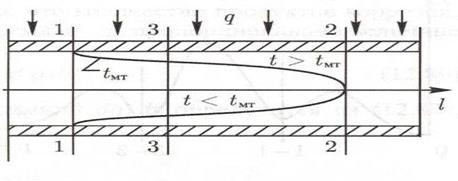
Рис.1.4. Граница температуры максимальной теплоемкости 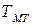 в потоке водного теплоносителя
в потоке водного теплоносителя
Когда температура среды в поверхностном слое у кристалла близка к 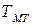 (в районе сечения 1-1 на рис. 1.4),
(в районе сечения 1-1 на рис. 1.4), 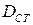 резко снижается, что тормозит сам процесс кристаллизации (рис. 1.5). Дальше по ходу среды
резко снижается, что тормозит сам процесс кристаллизации (рис. 1.5). Дальше по ходу среды 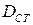 увеличивается, рост кристалла возобновляется. Но зона
увеличивается, рост кристалла возобновляется. Но зона 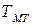 смещается в диффузионный пристенный слой,
смещается в диффузионный пристенный слой, 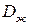 и скорость доставки резко уменьшаются (условно сечение 3-3 на рис. 1.4), что приводит к снижению скорости роста кристалла (рис. 1.5, сечение 3-3).
и скорость доставки резко уменьшаются (условно сечение 3-3 на рис. 1.4), что приводит к снижению скорости роста кристалла (рис. 1.5, сечение 3-3).
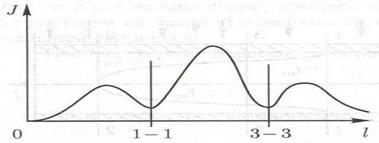
Рис. 1.5. Изменение скорости кристаллизации вещества 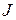 по длине обогреваемого канала.
по длине обогреваемого канала.
Таким образом, при изменении температуры водного теплоносителя СКД по длине трубы возможны участки, где скорость кристаллизации примеси и, следовательно, роста массы отложений на поверхности трубы замедляется из-за снижения скорости диффузии вещества.
1.2. Изменение массы отложившейся на стенке примеси во времени
Рассмотрим процессы на границе водный раствор-стенка трубы
(рис. 1.6). На поверхность стенки за счет кристаллизации вещества поступает 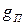 примеси за счет адсорбции
примеси за счет адсорбции 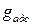 . Часть продуктов коррозии
. Часть продуктов коррозии 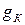 остается на поверхности стенки. Так как наружный слой отложений, как правило, рыхлый, неустойчивый, то часть отложений
остается на поверхности стенки. Так как наружный слой отложений, как правило, рыхлый, неустойчивый, то часть отложений 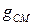 смывается и уносится потоком теплоносителя. В результате этих (и некоторых других) процессов на поверхности стенки образуется слой отложений
смывается и уносится потоком теплоносителя. В результате этих (и некоторых других) процессов на поверхности стенки образуется слой отложений 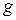 мг/м2. Так как в общем случае адсорбция мала, то в можно ей пренебречь.
мг/м2. Так как в общем случае адсорбция мала, то в можно ей пренебречь.
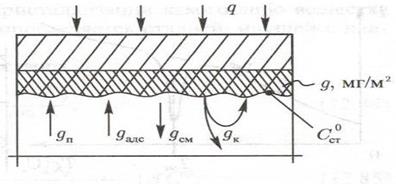
Рис.1.6. Схема потоков примеси в системе «слой отложений – водный теплоноситель».
Изменение массы отложившейся на стенке примеси во времени, в общем случае, определяется соотношением количества поступившей примеси и уносом (смывом) примеси со стенки. Количество поступившей примеси за время 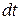 , с, на единицу поверхности стенки
, с, на единицу поверхности стенки 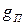 мг/м2, за счет ее кристаллизации равно
мг/м2, за счет ее кристаллизации равно
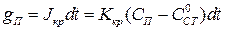 (1.10)
(1.10)
Смыв отложений 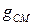 мг/м2 за время dt пропорционален величине отложений
мг/м2 за время dt пропорционален величине отложений 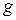 , мг/м2, и касательному напряжению
, мг/м2, и касательному напряжению 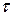 на границе слоя отложений
на границе слоя отложений
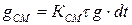 (1.11)
(1.11)
Местное уменьшение величины отложений может происходить не только путем их смыва, но и за счет механического разрушения защитной пленки при изменении температурного режима труб (пуск, останов, переменный режим), так как коэффициенты линейного расширения магнетита (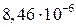 1/0С) и стали (
1/0С) и стали (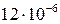 1/0С) существенно различаются.
1/0С) существенно различаются.
Количество отложений увеличивается путем коррозии металла. Скорость коррозии зависит от температуры. В частности, при температуре металла свыше 572°С процесс пароводяной коррозии интенсифицируется, при этом ускоряется рост отложений и температуры металла. Температура внутренней поверхности трубы зависит от толщины слоя отложений 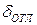 :
:
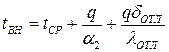
Следовательно, величина отложений влияет на скорость коррозионных процессов. Исходя из этого, запишем, что количество продуктов коррозии, поступивших в слой отложений за время 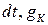 пропорционально величине отложений:
пропорционально величине отложений:
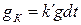 (1.12)
(1.12)
Суммарная скорость роста отложений 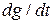 определится из (1.10), (1.11), (1.12):
определится из (1.10), (1.11), (1.12):
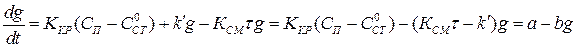 (1.13)
(1.13)
где 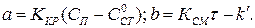 (1.14)
(1.14)
Начальные условия:
при 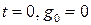 (1.15)
(1.15)
Наиболее простой вид формула (1.13) принимает при 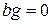
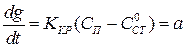 (1.16)
(1.16)
Это уравнение соответствует следующим условиям:
1. Величина отложений определяется процессом кристаллизации;
2. Величина 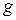 пренебрежимо мала, что возможно в начальный период образования отложений;
пренебрежимо мала, что возможно в начальный период образования отложений;
3. 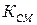 равно нулю – нет смыва отложений; за счет кристаллизации образуются мелкие кристаллы, которые к тому же уплотняются адсорбирующими молекулами;
равно нулю – нет смыва отложений; за счет кристаллизации образуются мелкие кристаллы, которые к тому же уплотняются адсорбирующими молекулами; 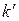 равно нулю – нет коррозии металла;
равно нулю – нет коррозии металла;
4. 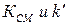 не равны нулю, но
не равны нулю, но 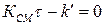 , т.е.
, т.е. 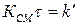 может иметь место при определенном сочетании параметров.
может иметь место при определенном сочетании параметров.
Решение уравнения (1.16) дает формулу прямой линии:
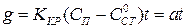 (1.17)
(1.17)
На рис. 1.7. эта прямая линия обозначена условием 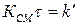 .
.
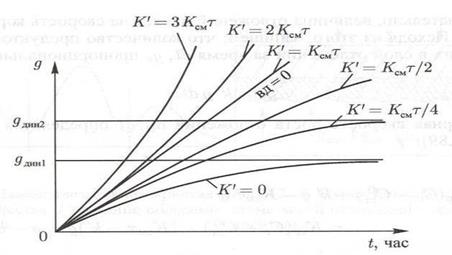
Рис. 1.7. Зависимость массы отложений 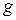 от времени процесса
от времени процесса 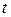 .
.
Приведем решение полного уравнения (1.13):
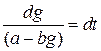 ;
; 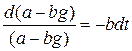 ;
;
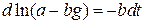 ;
; 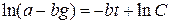 ; при
; при 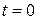 ;
; 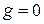 ;
; 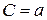 ;
;
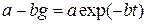 ;
;
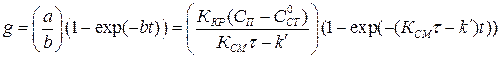 . (1.18)
. (1.18)
Если 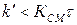 , то при
, то при 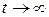 система приходит в динамическое равновесие:
система приходит в динамическое равновесие:
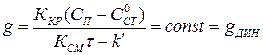 (1.19)
(1.19)
В этих условиях интенсивность смыва отложений равна интенсивности поступления примеси из потока воды и коррозии металла. Минимальная величина 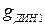 соответствует
соответствует 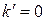 (рис. 1.7). При
(рис. 1.7). При 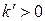 установление равновесия затягивается во времени, а величина
установление равновесия затягивается во времени, а величина 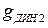 увеличивается. Влияние других факторов: а)
увеличивается. Влияние других факторов: а) 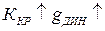 ; б)
; б) 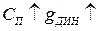 ; в)
; в) 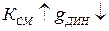 .
.
При 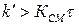 формула принимает вид:
формула принимает вид:
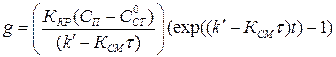 . (1.20)
. (1.20)
В этом случае динамическое равновесие не устанавливается, а при увеличении времени масса отложений растет с убыстряющейся скоростью
(рис. 1.7). Такой характер зависимости устанавливается при температуре стенки выше 572°С, когда интенсифицируется пароводяная коррозия. В начальный период роста отложений скорость коррозии мала (кривая 2, рис. 1.8) и величина 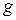 изменяется по кривой 1 (рис. 1.8). В момент времени
изменяется по кривой 1 (рис. 1.8). В момент времени 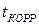 температура стенки достигает значения 572°С, кривая коррозии 2 резко возрастает и суммарная кривая 3 также растет.
температура стенки достигает значения 572°С, кривая коррозии 2 резко возрастает и суммарная кривая 3 также растет.
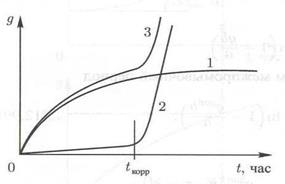
Рис. 1.8. Влияние коррозионных процессов на массу отложений примеси
В обогреваемых трубах по условиям обеспечения надежного температурного режима определяется предельно допустимая масса отложений 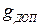 ,
, 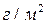 . Полученные зависимости дают возможность определить время работы поверхностей нагрева, за которое произойдет накопление
. Полученные зависимости дают возможность определить время работы поверхностей нагрева, за которое произойдет накопление 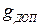 после чего необходимо производить химическую промывку поверхностей парового котла. Межпромывочный период
после чего необходимо производить химическую промывку поверхностей парового котла. Межпромывочный период 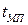 зависит от качества воды, водно-химического режима, теплового потока и т. п.
зависит от качества воды, водно-химического режима, теплового потока и т. п.
На рис. 1.9 показано изменение во времени t массы отложений на стенке 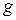 и температуры наружной поверхности стенки
и температуры наружной поверхности стенки 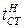 .
.
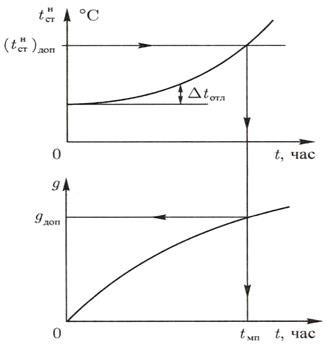
Рис. 1.9. Определение межпромывочного периода 
Максимально допустимой температуре стенки по окалинообразованию 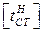 соответствует допустимая величина отложений
соответствует допустимая величина отложений 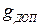 . По этой величине определяют время промывки поверхностей нагрева от образовавшихся отложений (межпромывочный период).
. По этой величине определяют время промывки поверхностей нагрева от образовавшихся отложений (межпромывочный период).
Из формулы (1.18) получаем
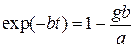 (1.21)
(1.21)
или 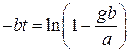
Отсюда 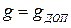 определяем межпромывочный период
определяем межпромывочный период
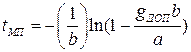 . (1.22)
. (1.22)
Раскрывая 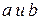 , получаем
, получаем
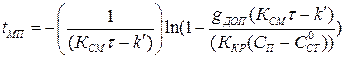 (1.23)
(1.23)
Выражение (1.23) дает возможность определить влияние различных факторов на межпромывочный период.
 2015-05-12
2015-05-12 2065
2065