| Определе-ние | Ÿ устройство, для преобразования энергии химических окислительно-восстановительных реакций в электрическую
Ÿ элемент Якоби-Даниэля (см.рис.2) состоит из двух металлических электродов, имеющих различные значения электродных потенциалов: цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди.
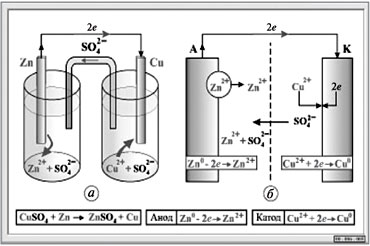 Рис.2 Схема элемента Даниэля-Якоби
Электроды соединены между собой металлическим проводником, а растворы – электролитическим ключом – П-образной стеклянной трубкой, выполняющей функции электролитического проводника с ионной проводимостью.
На цинковом (отрицательном) электроде происходит окисление атомов цинка до ионов Zn2+ (анодный процесс), которые переходят в раствор: Zn-2ē = Zn2+. Электроны перемещаются по металлическому проводнику к медному положительному электроду, где происходит восстановление катионов меди из раствора до атомов меди (катодный процесс):Сu2+ + 2ē = Cu. В результате около цинкового электрода электролит приобретает избыточное число положительно заряженных ионов Zn2+ по сравнению с количеством ионов SO42-, около медного электрода – недостаток ионов Сu2+; анионы SO42- по электролитическому ключу перемещаются из раствора CuSO4 в раствор ZnSO4, замыкая цепь.
Рис.2 Схема элемента Даниэля-Якоби
Электроды соединены между собой металлическим проводником, а растворы – электролитическим ключом – П-образной стеклянной трубкой, выполняющей функции электролитического проводника с ионной проводимостью.
На цинковом (отрицательном) электроде происходит окисление атомов цинка до ионов Zn2+ (анодный процесс), которые переходят в раствор: Zn-2ē = Zn2+. Электроны перемещаются по металлическому проводнику к медному положительному электроду, где происходит восстановление катионов меди из раствора до атомов меди (катодный процесс):Сu2+ + 2ē = Cu. В результате около цинкового электрода электролит приобретает избыточное число положительно заряженных ионов Zn2+ по сравнению с количеством ионов SO42-, около медного электрода – недостаток ионов Сu2+; анионы SO42- по электролитическому ключу перемещаются из раствора CuSO4 в раствор ZnSO4, замыкая цепь.
|
| Условная запись (краткая электрохимическая схема) гальванического элемента | Ÿ химическими символами записываются электроды и растворы, причем одна черта означает границу раздела между электродом и раствором, две черты – граница между растворами, в скобках знаки зарядов электродов. Символы анода записываются слева, катода – справа. Кроме того, могут быть указаны концентрации ионов в растворах: Анод (-) Zn|ZnSO4 (0,20М)||CuSO4(0,35М)|Cu (+) Катод (молекулярная форма записи) или Анод(-) Zn|Zn2+(0,20М)||Cu2+(0,35М)|Cu (+) Катод (ионная форма записи) |
| ЭДС гальванического элемента | Ÿ электродвижущая сила (ΔE) разность электродных потенциалов катода и анода (окислителя и восстановителя) при разомкнутой электрической цепи ΔE = Eкатод - Eанод = Eокислитель – Eвосстановитель |
| Связь термодинамических и химических параметров | • A = - Δ G = n F ΔE A – полезная работа; F – постоянная Фарадея; e – заряд иона; ΔG – изменение энергии Гиббса в результате протекания реакции; ΔE – разность электродных потенциалов между катодом и анодом |
Механизм возникновения электродного потенциала
|
|

Сейчас читают про:
 2015-06-26
2015-06-26 569
569







