11.1. Основные понятия и термины
| Определение | Ÿ раздел химии, занимающийся изучением связи между электрическими и химическими процессами, в результате которых происходит превращение химических видов энергии в электрическую (гальванический элемент) и, наоборот, электрической энергии в химическую (электролиз) |
| Электрод | Ÿ электронно-проводящие фазы (металлы, полупроводники), находящиеся в контакте с электролитом |
| Двойной электри-ческий слой | Ÿ перешедшие в раствор положительно заряженные ионы металла конценрируются у внешней поверхности металла, а свободные электроны – у его внутренней поверхности, образуя двойной слой зарядов (положительных и отрицательных) |
| Электродный потенциал (E) | Ÿ разность (скачок) электрических потенциалов, возникающая между металлом и жидкой фазой. При стандартных условиях − называется стандартным электродным потенциалом (E0). Значение E0 определяют по сравнению данного электрода с водородным электродом, Условное обозначение электродного потенциала: Е(Меn+/ Ме); единица измерения – вольт (В) |
| Водородный электрод | Ÿ электрод сравнения, состоящий из платиновой пластины с сильно развитой поверхностью (платиновая чернь), погруженной в раствор кислоты с концентрацией ионов H+ равной 1 моль/л, через раствор пропускают газообразный водород под давлением 101325 Па. |
| Потенциал водородного электрода | Ÿ при концентрации в растворе ионов Н+, равной 1 моль/л, давлении газообразного водорода 101325 Па и при температуре 298 K (стандартные условия) принят равным нулю.
Е˚ (Н+ / Н 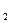 ) = 0 ) = 0
|
| Металл (Me) в воде | Ÿ свободные электроны в металле обладают высокой подвижностью, но за границу раздела металл – среда (вакуум, жидкость, газ) они не могут проникнуть без приложения дополнительного воздействия; под воздействием полярных молекул воды возможен переход положительно заряженных ионов металла в водную среду, в соответствии со схемой: Me0 + nH2O → Me+∙ nH2O + e¯ |
| Стандарт- ный электродный поттенциал | Ÿ потенциал электрода, измеренный при стандартных условиях. Если расположить металлы в порядке возрастания значений их стандартных электродных потенциалов, то получится ряд стандартных электродных потенциалов металлов (ряд напряжений) |
| Уравнение Нернста | Ÿ позволяет рассчитать значение электродного потенциала системы при условии отличных от стандартных RT E = E0 + ——— ln [Ox] / [Red] nF где: E0 – стандартное значение электродного потенциала, В; E – значение электродного потенциала в условиях, отличных от стандартных, В; R – универсальная газовая постоянная, Дж/(моль ∙ K); F – постоянная Фарадея, ≈ 96500 Кл/моль; n – число электронов, принимающих участие в окислительно-восстановительном процессе в расчете на одну частицу (атом, ион); [Ox] – концентрация ионов окисленной фазы, моль/л; [Red] – концентрация ионов восстановленной фазы, моль/л; T – температура, К; или (если перейти от натуральных логарифмов к десятичным, подставить значения R и F, T =298 K и принять [Red] = const): 0,0592 E = E0 + ——— lg [Me+n] n где [Me+n] – концентрация ионов металла в растворе |
| Уравнение Нернcта для водородного элетрода | Ÿ E = E0 + 0.059 lg[Н+] = 0 – 0.059 pH=
= – 0,059 pH;
при рН = 7 (нейтральная среда)
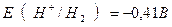 ;
при рН = 1 (кислая среда) ;
при рН = 1 (кислая среда)
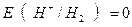
|
| Характери-стика свойств металлов (окислительно-восстановительных систем), получаемая с помощью ряда стандартных электродных потенциалов | а) чем меньше значение электродного потенциала металла, тем легче он окисляется и труднее восстанавливается; б) металлы, имеющие отрицательные значения электродных потенциалов, т.е. стоящие в ряду напряжений левее (выше) водорода, способны вытеснять (восстанавливать) его из неокисляющих кислот, в отличие от металлов с положительным значением электродного потенциала: Zn + 2HCl = ZnCl2 + H2 Cu +HCl ≠ в) каждый металл, не взаимодействующий с водой, вытесняет (восстанавливает) все следующие за ним в ряду стандартных электродных потенциалов металлы из растворов их солей: Fe + CuSO4 = FeSO4 + Cu или – в сокращенной ионной форме: Fe0 + Cu2+= Fe2+ +Cu0, но Cu0+ Fe2+≠ |
 2015-06-26
2015-06-26 342
342








