| СО в молекулах простых веществ | • равны нулю: 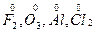
|
| Алгебраическая сумма СО атомов в молекулах | • равна нулю, (молекула электронейтральна)
например:
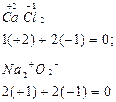
|
| Алгебраическая сумма СО атомов в ионах | • равна электрическому заряду данного иона;
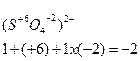
|
| СО металлов в соединениях | • всегда положительные
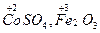
|
| Постоянные степени окисления проявляют | а)металлы главной подгруппы 1 группы таблицы Менделеева (+1): 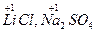 б)металлы главной подгруппы 2-й группы, а также Cd и Zn (+2):
б)металлы главной подгруппы 2-й группы, а также Cd и Zn (+2): 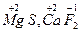 , , 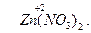 в) алюминий (+3)
г) фтор (-1)
в) алюминий (+3)
г) фтор (-1)
|
| Степени окисления других элементов периодической системы | а) водород во всех соединениях имеет степень окисления, равную плюс одному (+1), исключение составляют гидриды металлов, степень окисления водорода в которых равна минус одному (-1),
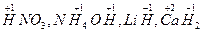 б) кислород в большинстве соединений имеет степень окисления, равную минус двум (-2),
б) кислород в большинстве соединений имеет степень окисления, равную минус двум (-2), 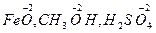 исключения составляют:
– пероксиды – здесь кислород имеет степень окисления, равную минус одному (-1),
исключения составляют:
– пероксиды – здесь кислород имеет степень окисления, равную минус одному (-1),
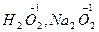 ,
– фторид и дифторид кислорода – здесь кислород имеет степень окисления плюс два (+2) и плюс один (+1), ,
– фторид и дифторид кислорода – здесь кислород имеет степень окисления плюс два (+2) и плюс один (+1),
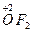 , , 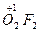 в) высшая положительная степень окисления атомов равна номеру группы в которой находится данный химический элемент (исключение: Cu, Ag, Au)
г) у элементов IV A– VII A групп низшая (отрицательная) степень окисления равна разности между номером группы и 8
д) как правило, промежуточные степени окисления элементов нечетных групп являются нечетными числами, четных – четными)
е) степень окисления может принимать дробное значение, если атомы химического элемента находятся в данном соединении в разных степенях окисления:
+8/3 -2 +2 +3 +1 -1/ 2
Fe3O4 (Fe Fe2O4 ); K2O4
в) высшая положительная степень окисления атомов равна номеру группы в которой находится данный химический элемент (исключение: Cu, Ag, Au)
г) у элементов IV A– VII A групп низшая (отрицательная) степень окисления равна разности между номером группы и 8
д) как правило, промежуточные степени окисления элементов нечетных групп являются нечетными числами, четных – четными)
е) степень окисления может принимать дробное значение, если атомы химического элемента находятся в данном соединении в разных степенях окисления:
+8/3 -2 +2 +3 +1 -1/ 2
Fe3O4 (Fe Fe2O4 ); K2O4
|
Правила определения степеней окисления (СО) атомов в свободном состоянии и в химических соединениях
|
|

Сейчас читают про:
 2015-06-26
2015-06-26 481
481







