Чередование α-спирализованных, β-структурированных и неспирализованных аморфных участков позволяет полипептидной цепи более плотно уложиться в пространстве. В разных белках наблюдается различное соотношение типов структур (Рис.4). Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% и 45% соответственно. 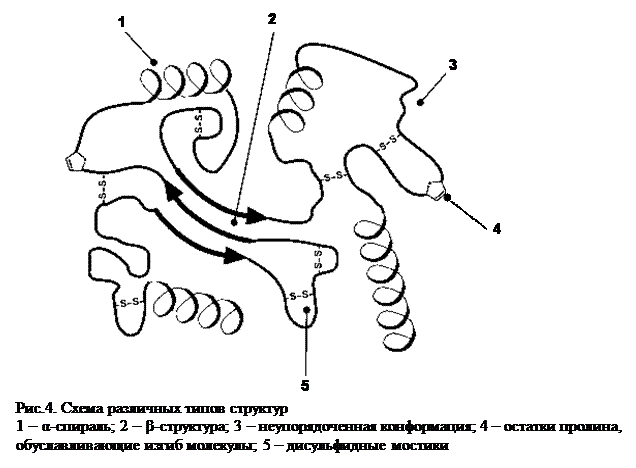
Первичная структура малоорганизованных участков включает пролин, особое строение которого провоцирует в цепи изгибы. Формирование глобул происходит в водной среде клетки, поэтому гидрофобные радикалы аминокислот «прячутся» внутрь сферы, образуя «жирную» каплю, а гидрофильные – будут направлены наружу, способствуя созданию гидратной оболочки мицеллы. Поэтому подобные белки хорошо растворимы в воде.
Стабилизируется с помощью различных дополнительных (добавочных) связей, например:
· водородных – между атомом водорода и более электроотрицательными атомами —ОН, —СООН, —NH2 группами радикалов аминокислот;
· дисульфидных – между остатками цистеина;
· гидрофобных – между радикалами алифатических и ароматических аминокислот;
· ионных – между группами —СОО– глутамата или аспартата и —NH3+ лизина или аргинина;
· псевдопептидных – между —СОО– группами глутамата или аспартата и —NH3+ группами лизина или аргинина;
· эфирных – между гидроксигруппами треонина и серина (простые) или карбоксильной группой (—СООН) аспартата, глутамата и –ОН гидроксикислот (сложноэфирная).
Биороль: способствует формированию четвертичной структуры, обуславливает выполнение функций.
 2015-06-26
2015-06-26 560
560








