Это структуры, содержащие белковую часть – апопротеин и небелковый компонент – простетическую группу. В зависимости от строения последней принято различать следующие их варианты.
Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Тип связи между апопротеином и небелковым компонентом – сложноэфирная, которая образуется при взаимодействии ОН-группы серина или треонина с фосфорной кислотой. К протеинам этого класса относятся казеиноген молока, фосфорилированные модификации гистонов, ферменты (РНК-полимеразы, некоторые фосфотрансферазы, фосфатазы) и другие, а также вителлин, фосвитин желтка и овальбумин белка яиц, ихтуллин икры рыб.
Остатки фосфорной кислоты, включённые в белки, находятся в диссоциированом состоянии, что придаёт молекуле сильный отрицательный заряд. Поэтому фосфопротеины могут легко взаимодействовать с лигандами или отталкивать их. Так, например, они связывают ионы Са2+ и транспортируют их.
Но главная особенность данной простетической группы – это возможность изменения конформации и заряда белковой молекулы, что сказывается на её свойствах и функциях. Реакция взаимодействия с фосфорной кислотой называется фосфорилирование или дефосфорилирование и используется, например, для регулирования активности ферментов и изменения функциональной активности биомембран (проницаемости и др.).
Фосфопротеины необходимы для развития зародыша, плода, новорожденного, т.к. содержат оптимальный набор аминокислот, а фосфорная кислота используется для формирования скелета (связывание ионов Са2+), для образования макроэргов – АТФ, АДФ и др., которые требуются в качестве источников энергии в реакциях синтеза, особенно интенсивно протекающих в растущем организме.
Нуклеопротеины – сложные белки, простетической группой которых являются нуклеотиды, и в первую очередь нуклеиновые кислоты – ДНК и РНК. В качестве апопротеина выступают белки гистоны, реже протамины. Так как эти протеины положительно заряжены, а нуклеиновые кислоты – отрицательно, то связь, образуемая между ними, ионная. Множество октамеров гистонов, комплексируясь с полинуклеотидом, образует нуклеосомы, которые затем компактно укладываются в органоидах (рис. 13). 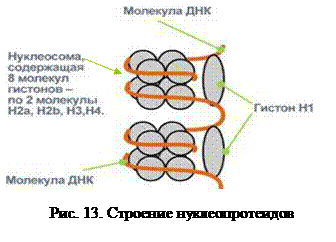
В функциональном отношении они отвечают за хранение и передачу наследственной информации и процессы биосинтеза белка.
Хромопротеины («цветные белки») своей окраской обязаны простетической группе – пигменту. В зависимости от строения различают следующие подклассы: гемопротеины, флавопротеины, родопсин.
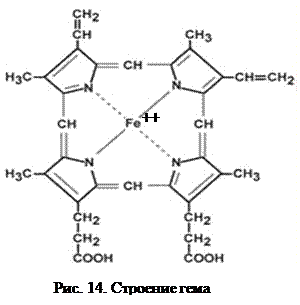 Гемопротеины (красные) – сложные белки, простетической группой которых служит гем. Он представлен порфирином, состоящим из 4-х пиррольных колец, соединённых метиновыми мостиками (—СН=). В центре располагаются ионы Fe2+ (гем b) или Mg2+ (гем а). Связь между апопротеином и небелковым компонентом координационная (донорно-акцепторная). Гемопротеины различаются по составу и структуре белка, обеспечивая разнообразие биофункций. Чаще всего встречается гем b (рис. 14). Он входит в состав гемоглобина (Hb) и миоглобина, обеспечивающих связывание газов, транспорт их эритроцитами или накопление кислорода миоцитами. Мицелла Hb состоит из четырёх полипептидных цепей и служит примером обладания биологическим свойством кооперативность (см. выше) – то есть у каждой последующей субъединицы сродство к кислороду выше предыдущей. Гемоглобин присоединяет кислород в условиях его высокого парциального давления и отдает соответственно в среде с низким содержанием этого газа. Сродство гемоглобина к монооксиду углерода больше, чем к кислороду, поэтому угарный газ (СО) может вытеснять кислород из оксигемоглобина. Образующийся карбоксигемоглобин не способен служить переносчиком кислорода, в тканях развивается гипоксия, опасная для клеток. Эта форма Hb имеет вишнево-красную окраску, обуславливающую цвет лица людей, отравившихся диоксидом углерода, что позволяет легко диагностировать токсическое действие газа. Зародышевый гемоглобин F (α2γ2) обладает более высоким сродством к кислороду, чем HbА взрослых людей. Благодаря этому возможен оптимальный перенос газа от матери к плоду.
Гемопротеины (красные) – сложные белки, простетической группой которых служит гем. Он представлен порфирином, состоящим из 4-х пиррольных колец, соединённых метиновыми мостиками (—СН=). В центре располагаются ионы Fe2+ (гем b) или Mg2+ (гем а). Связь между апопротеином и небелковым компонентом координационная (донорно-акцепторная). Гемопротеины различаются по составу и структуре белка, обеспечивая разнообразие биофункций. Чаще всего встречается гем b (рис. 14). Он входит в состав гемоглобина (Hb) и миоглобина, обеспечивающих связывание газов, транспорт их эритроцитами или накопление кислорода миоцитами. Мицелла Hb состоит из четырёх полипептидных цепей и служит примером обладания биологическим свойством кооперативность (см. выше) – то есть у каждой последующей субъединицы сродство к кислороду выше предыдущей. Гемоглобин присоединяет кислород в условиях его высокого парциального давления и отдает соответственно в среде с низким содержанием этого газа. Сродство гемоглобина к монооксиду углерода больше, чем к кислороду, поэтому угарный газ (СО) может вытеснять кислород из оксигемоглобина. Образующийся карбоксигемоглобин не способен служить переносчиком кислорода, в тканях развивается гипоксия, опасная для клеток. Эта форма Hb имеет вишнево-красную окраску, обуславливающую цвет лица людей, отравившихся диоксидом углерода, что позволяет легко диагностировать токсическое действие газа. Зародышевый гемоглобин F (α2γ2) обладает более высоким сродством к кислороду, чем HbА взрослых людей. Благодаря этому возможен оптимальный перенос газа от матери к плоду.
Миоглобин – небольшой глобулярный белок (Mr 16500 Да); молекула его состоит из одной полипептидной цепи (153 а/к) и одного гема. Сродство к кислороду у данного гемопротеида значительно больше, чем у гемоглобина, поэтому он может принимать газ от последнего для сохранения или использования его в мышечных клетках.
Гем b является также структурной единицей ферментов каталазы и пероксидазы, обезвреживающих пероксиды, и цитохромов – митохондриальных белков, участвующих в переносе электронов от окисляемых веществ в конечном итоге на кислород за счёт своей способности изменять валентность железа.
Гем а встречается в растительных гемопротеинах и участвует в процессе фотосинтеза.
Флавопротеины ( flavus - жёлтый). Их простетической группой служат активные формы витамина В2 (рибофлавин) – ФАД (флавинадениндинуклеотид), ФМН (флавинмононуклеотид). Классический пример данного вида белков оксидоредуктазы — ферменты, катализирующие окислительно-восстановительные реакции в клетке. В некоторые флавоноиды включены ионы металлов - металлофлавопротеины или молекула гема – флавогемопротеины. Их типичными представителями, содержащими также негемовое железо, являются альдегидоксидаза, ксантинДГ, дигидрооротатДГ, ацил-КоА-ДГ. На долю последних приходится до 80 % митохондриальных белков, выполняющих важную роль в биоэнергетике клетки.
Родопсин (от греч. rhodos — пурпур и opsis — зрение) – это белок, простетической группой которого является активная форма витамина А – ретиналь. Апопротеин связан с ним иминной связью. Родопсин - основное светочувствительное вещество палочек сетчатки глаза. Его функция состоит в восприятии света в сумерках, т.е. он отвечает за сумеречное зрение.
Металлопротеины – сложные белки, где роль небелкового компонента выполняют катионы металлов. Связь между ними ионная или координационная (донорно-акцепторная). Типичными представителями таких белков являются железосодержащие белки.
Ферритин. В его составе ионы Fe3+ депонируются в клетках селезёнки, костного мозга, но богаче всего этим белком печень. Там может накапливаться до 700 мг железа, которое используется по мере надобности для синтеза гема. Гемосидерин – это комплекс гликопротеина и ионов железа, образуется в тканях при кумулировании избытка железа. Трансферрин – растворимый в воде железопротеин, содержащий ещё олигосахариды (металлогликопротеин). Этот белок вырабатывается гепатоцитами и секретируется в кровь, где служит для транспорта катионов этого металла к клеткам других органов. Молекула трансферрина удерживает два иона железа, которые захватывает в кишечнике или местах распада гема, и осуществляет их перенос к точкам депонирования и утилизации. Церулоплазмин аналогично трансферрину обеспечивает транспорт катионов металла, только восьми ионов меди.
Кроме того, многие ферменты в свой активный центр включают различные ионы металлов, выступающие в роли Ко-фактора: Zn2+ - в алкогольдегидрогеназу (алкогольДГ), Mn2+ - в аргиназу, Mg2+ - в гексокиназу, Мо2+ - в ксантинДГ и другие.
Гликопротеины,или гликоконъюгаты. В них простетическая группа представлена углеводными компонентами и связана с белком О-гликозидными (реже N-гликозидными) связями. Небелковый фрагмент некоторых гликопротеидов редко бывает представлен одним моносахаридом; как правило, это олиго- или полисахаридные разветвлённые цепочки. Причём на долю углеводов может приходиться от 1 до 85%.
Исходя из вклада в общую копилку, выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между ними имеются существенные отличия:
Таблица 1
 2015-06-26
2015-06-26 11671
11671
