По характеру выполняемых функций белки
можно разделить на следующие группы:
ферменты;
рецепторные белки;
регуляторные белки;
структурные белки;
транспортные белки;
защитные белки;
Все 20 аминокислот, встречающихся в белках, — это α-амино-
кислоты, общим признаком которых является наличие аминогруппы – NН2 и
карбоксильной группы — СООН у α-углеродного атома. Исключением является пролин, который содержит в α-положении группу — NH и называется иминокислотой.
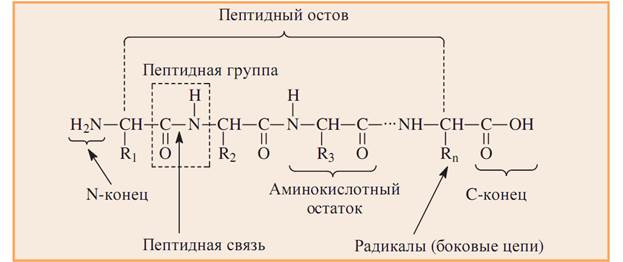
Пептидная связь-это амидная ковалентная связь, соединяющая аминокислоты в полипептидную цепочку (протомер) (CO-NH) или (О=С-N-Н)
Последовательность аминокислот в цепи изображают, начиная с N-концевой аминокислоты. С нее же начинается нумерация аминокислотных
остатков.
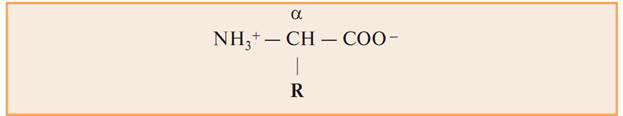


Конформация- распределение полипептидной цепи в пространстве. (уникальность конформации, определяется первичной структурой полипептидной цепи).
Водородная связь- С=О…НN
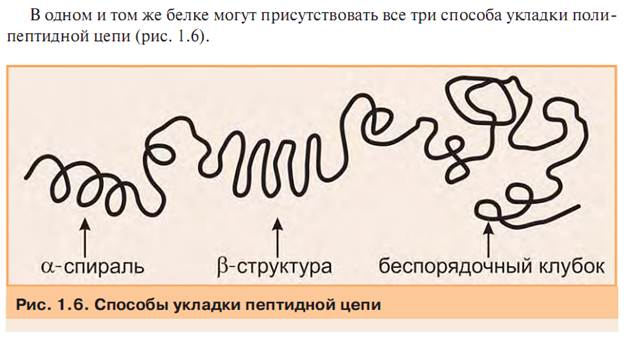
Вторичная структура белка образуется путем водородного взаимодействия групп пептидной связи.
Альфа-спираль-NH-группа одного остатка аминокислоты с СО-группой четвертого от нее остатка.
Бета- складчатая структура- может формироваться между двумя цепями, или между участками одной цепи, путем той же водородной связи.
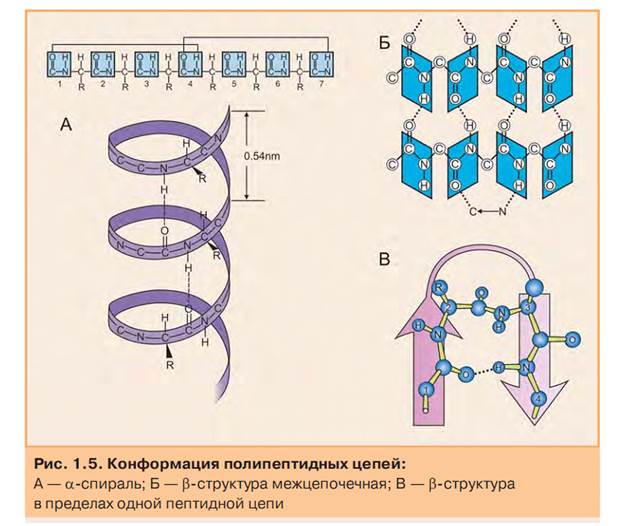
Беспорядочный клубок-молекула белка, не имеющая правильной упорядоченной организации. (эта конформация определяется первичной структурой белка.)
Третичная структура-способ укладки в пространстве вторичной структуры (альфа,бета, и беспорядочной структур).
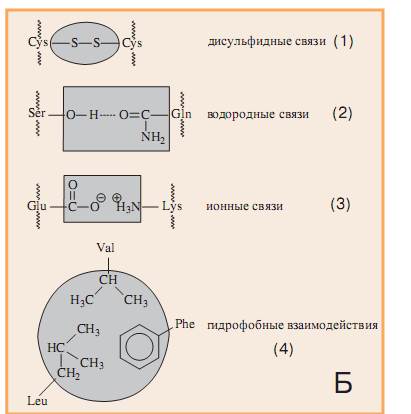
Третичная структура сохраняет свою форму благодаря взаимодействию боковых аминокислотных радикалов (R). Связи между радикалами, в основном носят нековалентный характер:
1.Ионные связи между радикалами.
2.Водородные связи между полярными (водородными) радикалами.
3.Гидрофобные взаимодействия между неполярными радикалами.
4.Дисульфидные связи между радикалами двух молекул цистеина.
Третичная структура белка так же определяется первичной структурой полипептидной цепи.
Фибриллярные белки- имеют конформацию только альфа-спирали, или бета-структуры.
Глобулярные белки- состоят из свернутых в глобулы полипептидных цепей, в разных частях своей молекулы могут содержать, как в альфа так и бета-структуры.
Доменные белки- белки состоящие из 200 и более аминокислот и, содержащие домены.
Домен- пространственная структура (глобула), образованная в пределах одной и той же цепи белка. (бывает два и более доменов). Домены могут отличаться по структуре и функциям, образуя многофункциональные белки.
Денатурация белка-нарушение его пространственной структуры, путем изменения внутренних связей между аминогруппами, карбоксильными группами и ам. радикалами, денатурирующим агентом. (изменение РН, температуры, внесение хим. в-в.)
Первичная структура не утрачивается, но белок теряет свои свойства.
Ренативация белка-восстановление белком своей функции, после удаления денатурирующего агента.
Суммарный заряд белка-соотношение положительно и отрицательно заряженных радикалов аминокислот.
Изоэлектрическое состояние- индивидуальное для каждого белка значение РН, когда число положительно и отрицательно заряженных аминокислотных радикалов становится равным (суммарный заряд молекулы=0).
Изоэлектрическая точка-значение РН при котором молекула белка достигает изоэлектрического состояния.
В изоэлектрическом состоянии белки образуют конгломераты и выпадают в осадок.
Большинство белков имеет гидрофильную поверхность, которая позволяет им находиться в растворимом состоянии в клетке. Но существуют и гидрофобные белки, на поверхности которых находятся преимущественно гидрофобные радикалы. Такие белки характерны для клеточных мембран.
Итак, растворимость белков в водной среде зависит от количества гидрофильных групп, размеров и формы молекулы, величины суммарного заряда.
Лиганд-вещество,с которым избирательно взаимодействует белковая молекула.

Чем меньше константа диссоциации,тем выше сродство белка к лиганду.
Активный центр (центр связывания)-участок белковой молекулы к которому присоединяется лиганд, с помощью ковалентной и нековалентной связи.
Белок высокоспецифичен к лиганду (комплиментарен).
Холопротеин (сложный белок) - белок, содержащий компоненты небелковой природы.
Простетическая группа - небелковая часть, сложного белка.
Апопротеин- белковая часть сложного белка.
Четвертичная структура белка (олигомеры) - белки построенные из двух и более пептидных цепей.
В четвертичной структуре протомеры связаны в определенных (контактных) центрах, по принципу комплементарности, нековалентными связями (ионные, водородные, гидрофобные).
Аллостерические центры-участки, удаленные от активного центра олигомера, но способные взаимодействовать с лигандами.
Аллостерический лиганд- лиганд, взаимодействующий с аллостерическим центром.
Кооперативный эффект-связывание лиганда с одним протомером, меняет конформацию этого протомера, что в свою очередь, изменяет конформацию всего олигомера, что меняет его сродство к другим лигандам.
Ингибитор белка - лиганд, который взаимодействует с активным центром белка или с его другой частью, нарушает функцию этого белка.
Изофункциональные белки, или изобелки, — это семейство белков, выполняющих в организме одинаковую функцию, но имеющих небольшие отличия в структуре.
 2015-05-20
2015-05-20 3082
3082