Приборы и реактивы: Фенол 75%, термометр (0-100ºС), пробирки, водяная баня, стаканчики.
Готовится 70% раствор фенола в воде. Наливаем его в широкую пробирку, опускаем термометр.
70% раствор фенола готовится из 75% раствора фенола, разбавлением его водой. Т.к. плотность 75% раствора фенола равна 1,066, то 6 мл раствора весят 6,396 г.(6х1,066=6,396г.). В 6 мл 75% раствора содержится чистого фенола 4,797 г.
6,396 – 100%
Х – 75% 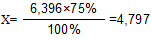
Количество воды, которое необходимо добавить для получения 70% раствора, рассчитывается следующим образом: 70 г. фенола содержится в 100 г раствора,
4,797 г. ------------------------- Х1 раствора.
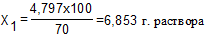
(общая масса раствора)
6,853 – 6,396 = 0,457 г. (масса воды), т.е. для получения 70% р-ра фенола необходимо к 6 мл 75% р-ра добавить 0,457 мл воды
(ρ воды=1).
В приготовленном 70% растворе определяем температуру гомогенизации. Для этого нагреваем пробирку с раствором на водяной бане, при помешивании и отмечаем температуру исчезновения мути. После этого пробирку вынимаем из бани и охлаждаем на воздухе, также помешивая. Теперь отмечаем температуру появления мути. (Нагревание и охлаждение раствора фенола проводят 2-3 раза, для получения точного значения температуры).
Далее готовят 65% раствор фенола разбавляя 70% раствор. Необходимое количество воды рассчитывается следующим образом:
65 г. фенола содержится в 100 г. раствора
4,797-----------------------------Х2 г. раствора
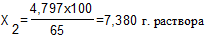
7,380 – 6,852 = 0,527 г. воды
Следовательно, в пробирку нужно добавить 0,527 мл воды. Приготовив таким образом, раствор фенола 65% раствор фенола, определяем аналогичным образом температуру гомогенизации. Затем готовим последовательно 60%, 50% и 35% растворы фенола в воде и находим температуру гомогенизации для каждого раствора.
Для получения значений температуры гомогенизации на второй ветви кривой, готовим сначала 20% раствор фенола в воде. Наливаем в пробирку 1,5 мл 75% раствора и добавляем к нему такое количество воды, чтобы получился 20% раствор. Расчеты проводим таким образом, как было описано выше. После этого определяем для 20% раствора температуру гомогенизации. Затем последовательно готовим 14%, 10% и 8,5% растворы фенола, каждый раз добавляя необходимое количество воды, и находим температуры гомогенизации для каждого раствора.
По полученным данным строим диаграмму фенол-вода, откладывая на оси ординат температуру гомогенизации, а на оси абсцисс – состав. После этого по графику находим температуру и состав критической точки.
Оформление работы:
- Кратко описать содержание работы.
- Рассчитать количество воды, которое необходимо добавить к исходному 75% раствору фенола в воде для 70%, 65%, 60%, 50%, 35%, 20%, 14%,10% и 8,5% растворов.
- Записать значения температур гомогенизации для растворов фенола в таблицу:
Контрольные вопросы:
1. Понятия: системы (гомогенная, гетерогенная), фаза, компонент, термодинамические параметры, термодинамическая степень свободы?
2. Правило фаз Гиббса. Вывод. Анализ.
3. Диаграмма состояния воды. Анализ диаграммы.
4. Физико-химический анализ. Суть. Принцип непрерывности, принцип соответствия.
5. Система с эвтектикой. Анализ. Кривые охлаждения.
6. Диаграмма состояния с химическим соединением, плавящимся конгруэнтно. Анализ. Кривые охлаждения.
7. Правило рычага.
8. Диаграмма состояния системы с химическим соединением, плавящимся инконгруэнтно. Анализ. Кривые охлаждения.
9. Диаграмма состояния системы с неограниченной растворимостью компонентов в твердом состоянии.
10. Ограниченно растворимые жидкости:
а) с верхней критической температурой растворения, анализ.
б) с нижней критической температурой растворения, анализ.
в) с верхней и нижней критическими температурами растворения,
анализ.
11. Правило Алексеева.
Список литературы
1. Киреев В. А. Курс физической химии. 1975г.
2. Стромберг А. Г., Семченко И. К. Практикум по физической
химии. 1988г.
3. Шаталов А. Я., Маршаков И. К. Практикум по физической
химии. 1975г.
4. Краткий справочник физико-технических величин. /Под.ред.
А А. Равделя и А. М. Пономаревой. 1983г.
5. Евстратова К. И.. Купина И. А.. Малахова Е. Е.
Физическая к коллоидная химия. 1980г.
6. Голиков Г. А. Руководство по физической химии. 1998г.
7. Глазов В. М. Основы физической химии. 1982г.
 2015-07-04
2015-07-04 2507
2507







