| Степень кровопотери | Удельный вес | Гемоглобин, г/л | Гематокрит, % |
| Лёгкая степень (до 10% ОЦК) | 1057-1054 | 120-100 | 44-40 |
| Средняя степень (до 20% ОЦК) | 1053-1050 | 99-85 | 39-32 |
| Тяжёлая степень (до 30% ОЦК) | 1049-1044 | 84-70 | 31-23 |
| Массивная (более 30%) | Менее 1044 | Менее 70 | Менее 23 |
Лечение кровопотери складывается из возмещения дефицита ОЦК и коррекции качественных показателей крови.
Для возмещения дефицита ОЦК используют кровезаменители (полиглюкин, реополиглюкин, макродекс, оксиэтилкрахмал, желатиноль), препараты крови (нативная или леофилизированая плазма, альбумин) и эритроцитную массу. Возмещение дефицита ОЦК начинают с вливания кристаллоидов, что улучшает капиллярный кровоток и уменьшает депонирование форменных элементов крови. При кровопотере более 30% ОЦК часть объёма инфузии должна составлять эритроцитная масса. Если отсутствуют данные об объёме кровопотери, показаниями к трансфузии эритроцитной массы является снижение гемоглобина ниже 70 г/л и гематокрита ниже 25%. Для адекватной заместительной терапии необходимо знать величину кровопотери. Объём инфузии должен превышать объём потери в 1,5 раза при потере 20% ОЦК, в 2.0 - 2,5 раза при потере 40% ОЦК и в 3 раза при потере 50% ОЦК.
При успешной остановке кровотечения и возмещении ОЦК исходом острой кровопотери является постгеморрагическая анемия. При дальнейшем лечении восстановление количественных показателей (массы крови) происходит в течение 5 дней, а нормализация качественных показателей крови (Нb и Нt) в течение 3-х недель. При продолжающемся кровотечении или неадекватной возмещении объема кровопотери разливается геморрагический шок. Особенностью геморрагического шока является быстрое восстановление гемодинамических нарушений при эффективной остановке кровотечения и адекватной объёмовозместительной терапии.
2. Синдром хронической постгеморрагической анемии. Она относится к железо дефицитной анемии и характеризуется следующими клиническими признаками: бледностью кожных покровов и слизистых, признаками ишемии головного мозга (головная боль, головокружение, потемнение в глазах), признаками ишемии сердечной мышцы (стенокардия, систолический шум), изменения в анализе крови (гипохромная анемия, лейкопения с нейтропенией, увеличение СОЭ, уменьшение сывороточного железа). Нормальный показатель сывороточного железа, составляет 18 мкмоль/л.
Основой лечения хронической постгеморрагической анемии является устранение источника кровопотери или устранение физиологических нарушений, приводящих к кровопотере. На этом фоне проводится коррекция качественных показателей кропи. Если качественные показатели ниже критических, то показано переливание эритроцитной массы. В основном же восполнение форменных элементов крови при хронической постгеморрагической анемии достигают препаратами, стимулирующими гемопоэз. Это - препараты железа для перорального (актиферрин, гемофер, ферронал и др.) и парентерального (феррум лек, эктофер) введения. Эффективность стимуляции гемопоэза оценивают по возникновению через 10 дней от начала лечения ретикулоцитарного криза. Анемия начинает уменьшаться только через 3 недели.
3. Синдром сдавления внутренних органов. Кровь может изливаться в различные полости: перикард, плевральную полость, сустав. При кровотечении в перикард возникает тампонада сердца и развивается кардиогенный шок. При кровотечении в плевральную полость развивается коллапс лёгкого и острая дыхательная недостаточность. При кровотечении в сустав (гемартроз) в последующем развивается анкилоз сустава в связи с организацией излившейся крови.
Примерами исхода кровотечения в паренхиматозные органы является развитие гематом (внутричерепной, печени и селезенки) с их последующим нагноением или организацией и образованием рубца. При межмышечной гематоме может происходить сдавление сосудов и нервов. Иногда продолжающееся постепенное накопление крови в паренхиматозном органе может привести к разрыву его капсулы (двухфазный разрыв паренхиматозного органа) и острой кровопотере в более поздние сроки.
Лечение больных с синдромом с давления внутренних органов помимо остановки кровотечения включает шакуацию скопившейся в полости крови пункцией, а при необходимости - вскрытие гематомы
4. Развитие аневризмы. Аневризмы бывают истинные и ложные. При истинной или расслаивающейся аневризме кровь проникает между слоями сосудистой стенки. Ложная аневризма является пульсирующей гематомой. Она развивается при повреждении артериального или венозного сосуда, и полость её сообщается с повреждённым функционирующим сосудом. Со временем вокруг ложной аневризмы формируется соединительнотканная капсула, но остаётся высокий риск её разрыва или тромбоза с последующей тромбоэмболией.
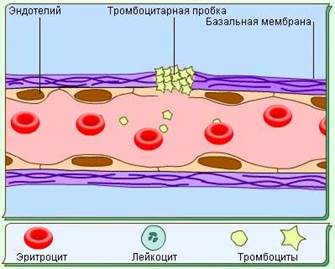 Гемостаз (остановка кровотечения).
Гемостаз (остановка кровотечения).
Различают физиологический гемостаз (самопроизвольная остановка кровотечения в результате образования сгустка крови в просвете сосуда) и лечебный гемостаз - остановку кровотечения под воздействием различных лечебных мероприятий.
Механизм формирования кровяного сгустка делится на 2 фазы: первичный и вторичный гемостаз.
Первичный гемостаз (15-60_сек).
Адгезия-тромбоцитов Рефлекторный Гуморальный
 на повреждённой механизм механизм
на повреждённой механизм механизм
 стенке сосуда серопюнин
стенке сосуда серопюнин
 адренатн
адренатн
норадреналин
 Агрегация тромбоцитов Вазоконстрикция
Агрегация тромбоцитов Вазоконстрикция
 тромбоцшпарныи сгусток
тромбоцшпарныи сгусток
Остановка кровотечения.
Вторичный гемостаз (протекает параллельно с первичным).
В результате активации внутрисосудистых и тканевых прокоагулянтов (экзогенная и эндогенная система) формируется тромбопластиновый комплекс (Iфаза свёртывания крови), под воздействием которого протромбин переходит в тромбин (// фаза свёртывания крови). Тромбин способствует переходу (фибриногена в фибрин (III фаза свёртывания крови). Метаморфоза фибрина протекает под воздействием ФСФ (фибрин стабилизирующего фактора) и ретрактозима от растворимого фибрина мономера до стабильного фибрина полимера, образующего плотный сгусток. На плотный сгусток воздействуют плазминоген-плазмин (фибринолиз), что может вызвать растворение сгустка.
Среди нарушений гемостаза различают врождённые и приобретенные коагулопатии обусловленные патологией тромбоцитов, плазменно-обусловленные и обусловленные патологией сосудов. В числе приобретённых плазменно-обусловленных коагулопатий - синдром ДВС (диссеминированное внутрисосудиетое свёртывание). Синонимы синдрома: коагулопатия потребления, тромбгеморрагическии синдром, афибриногенэмический синдром и другие. Основными факторами, способствующими развитию синдрома ДВС, являются: большие операции, распадающиеся злокачественные опухоли, лейкоз и шок во всех его проявлениях.
Синдром ДВС развивается в следующей последовательности: 1) повреждение тканей, обладающих высокой тромбопластической активностью; 2) высвобождение тромбоцитов; 3) одновременная генерация тромбина и плазмина: 4) массивное образование фибрина с распадом его до фрагментов (фибрин-мономер). Далее реакция протекает в 2 фазы. В I фазе происходит образование тромбоцитарно-фибриновых сгустков в микроциркуляторной системе, а затем ишемические, геморрагические и некротические изменения в жизненно важных органах. Во II фазе развивается гипокоагуляция в связи с потреблением прокоа-гулирующих факторов и тромбоцитов с последующей активацией фибриноли-тического звена.
Экспресс - диагностика синдрома ДВС включает исследование:
1) тромбинового времени - ТВ (К = 20-30 сек), которое позволяет в связи с включением в процесс гемокоагуляции стабилизированной крови готового тромбина (выключение I фазы свёртывания крови) исследовать III фазу;
2) времени рекальцификации плазмы - ВРП (К = 120-150 сек), которое позволяет оценить активность процессов гемокоагуляции в целом во всех 3 его фазах путём рекальцификации стабилизированной крови;
3) фибринолитической активности - ФА, которая при соответствующей методике быстро и точно оценивает состояние факторов лизиса.
 2015-07-04
2015-07-04 701
701








