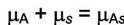
|
(6.1)
Выразим химические потенциалы компонентов:
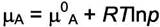
|
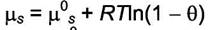
|
| - для свободных адсорбционных центров; |
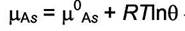
|
| - для комплексов адсорбат - адсорбент. |
- для свободных молекул адсорбата;
В этих уравнениях 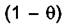 выступает в качестве мольной доли свободных
выступает в качестве мольной доли свободных
центров, а 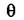 - мольной доли занятых центров. Подставим значения химических потенциалов в (6.1)
- мольной доли занятых центров. Подставим значения химических потенциалов в (6.1)

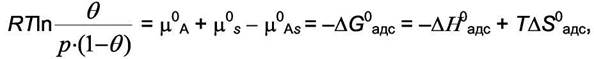
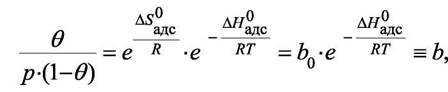
где "b" - адсорбционный коэффициент, а по смыслу константа равновесия для процесса адсорбции  . Последнее уравнение удобнее разрешить относительно доли занятой адсорбируемым газом поверхности θ:
. Последнее уравнение удобнее разрешить относительно доли занятой адсорбируемым газом поверхности θ:
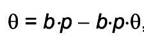
|
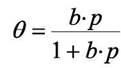
|
откуда
(6.2)
Уравнение (6.2) носит название уравнения Лэнгмюра.
Запишем уравнение (6.2) в другом виде, введя величину адсорбции.
По определению 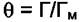 и тогда
и тогда
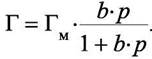
|
(6.3)
Из зависимости 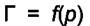 можно найти величины
можно найти величины 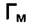 и "b". Для этого
и "b". Для этого
перепишем (6.3) так:
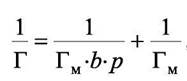
|
(6.4)
т. е. в координатах 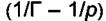 будет прямая линия, тангенс угла наклона
будет прямая линия, тангенс угла наклона
которой равен 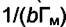 , и отсекающая на оси ординат отрезок
, и отсекающая на оси ординат отрезок 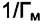
Зависимость (6.4) изображена на рис. 6.1. Обработка экспериментальных результатов в этих координатах позволяет определить величину максимальной адсорбции 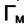 и константу равновесия процесса адсорбции «b».
и константу равновесия процесса адсорбции «b».
С ростом температуры при постоянном p величина "b" уменьшается, следовательно, и величина Г будет уменьшаться. Изотерма
| Рис. 6.1 Изотерма адсорбции. |
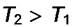 пойдёт ниже, но будет стремиться к
пойдёт ниже, но будет стремиться к 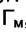 , которое от Т не зависит (см. рис. 6.2).
, которое от Т не зависит (см. рис. 6.2).
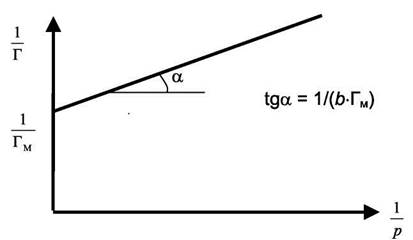
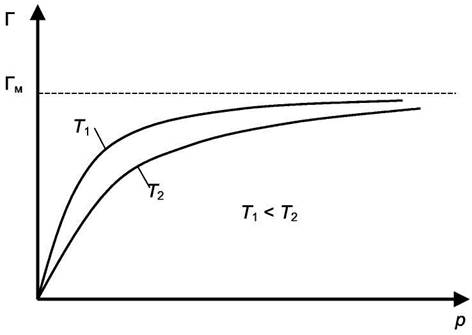
Рис. 6.2. Влияние температуры на вид изотермы адсорбции.
При малых давлениях p величина 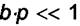 , и (6.3) превращается в
, и (6.3) превращается в
 2015-07-04
2015-07-04 345
345








