Над твёрдой поверхностью имеется смесь газов из i компонент. Обозначим θi долю поверхности s, занятой i - ым компонентом, причём 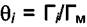 . Согласно третьему предположению Лэнгмюра
. Согласно третьему предположению Лэнгмюра 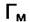 одинаковы для всех газовых компонент, а
одинаковы для всех газовых компонент, а 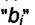 - различны в основном за счёт отличия в теплотах адсорбции. Для каждого компонента имеем
- различны в основном за счёт отличия в теплотах адсорбции. Для каждого компонента имеем
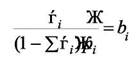
|
Введем понятие доли свободной поверхности 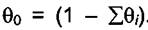 . Тогда
. Тогда
уравнение Лэнгмюра запишется в виде
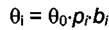
где 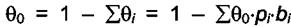 . Из последнего уравнения можно
. Из последнего уравнения можно
записать
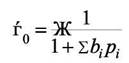
|
и для доли поверхности, занятой i- ым компонентом имеем
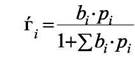
|
(6.6)
Формула (6.6) описывает адсорбционную конкуренцию компонент за обладание центрами адсорбции.
Величины bi могут отличаться в десятки и сотни тысяч раз. Предположим, что для двух газов адсорбционные коэффициенты отличаются в 105 раз. Тогда при равенстве b0 имеем
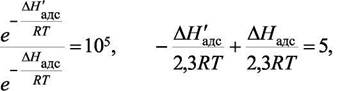
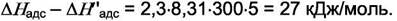
Если теплоты адсорбции отличаются на ~ 27 кДж/моль у двух газов, то их адсорбционные коэффициенты отличаются в 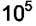 раз.
раз.
На разнице адсорбционных коэффициентов и основана работа противогаза. Газов 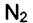 и
и 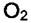 в воздухе много, но их
в воздухе много, но их 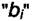 на угле мало, а примеси
на угле мало, а примеси 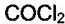 ,
, 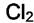 в воздухе могут быть малыми, но их bi велики.
в воздухе могут быть малыми, но их bi велики.
Поэтому активный элемент противогаза адсорбирует хлорсодержащие газы сильно и значительно снижает их концентрации во вдыхаемом воздухе. Газ, про который говорят, что он адсорбируется сильно, имеет
произведение 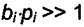
Если газ адсорбируется слабо, это означает, что его
адсорбционный коэффициент 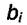 мал и величиной
мал и величиной 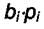 в знаменателе (6.6) можно пренебречь по сравнению с остальными членами.
в знаменателе (6.6) можно пренебречь по сравнению с остальными членами.
 2015-07-04
2015-07-04 869
869








