Процессы, в которых участвуют система, могут протекать при различных условиях.
Процесс, происходящий при постоянном объеме (V = сonst, DV = 0), называется изохорическим.
QV = DU = U2 – U1, (3)
где QV – изохорический тепловой эффект химической реакции.
Процесс, идущий при постоянном давлении (р = сonst), называется изобарическим.
Qр = DH = H2 – H1 = DU + p DV, (4)
где Qp – изобарический тепловой эффект; H2, H1 – соответственно энтальпии продуктов реакции и исходных веществ; DH – изменение энтальпии процесса; H = U + pV; p – давление; V – объем, занимаемый системой.
Для изотермического процесса (Т =const) изменение внутренней энергии DU = 0, следовательно, dQ = pdV.
Для идеального (разреженного реального) газа, используя уравнение Менделеева-Клайперона, записать его относительно p
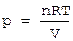 (5)
(5)
проведем интегрирование:
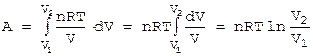 (6)
(6)
Работа адиабатического процесса (Q = 0) может быть определена следующими наиболее часто применимыми уравнениями:
А = -DU (7)
А = nCv (T1 – T2); (8)
А = (p1 V1 – p2 V2)/(g-1), (9)
где g = Ср/Сv (10)
Ср – изобарная теплоемкость; Сv – изохорная теплоемкость.
|
|
|
Выражения зависимости работы и теплоты от параметров р, V, T системы в конечном 2 и начальном 1 состоянии в четырех основных процессах с идеальными газами совместно с уравнениями состояния газа приведены в табл. 3.
Таблица 3 - Выражения зависимости работы и теплоты от параметров системы совместно с уравнениями состояния газа
| Процесс | Работа | Теплота | Уравнение состояния газа |
| Изохорический | 0 | nCv(T2-T1) | p/T = const |
| Изобарический | p(V2-V1) | nCp(T2-T1) | V/T = const |
| Изотермический | nRTln(V2/V1) | nRTln(p1/p2) | pV = const |
| Адиабитический | nCv(T2-T1); (p1 V1 – p2 V2)/(g-1) | 0 | pVg = const ТVg-1 = const Тр(g-1)/g = const |
Выражение для взаимосвязи молярной (атомной) теплоемкости идеальных газов при постоянном давлении Cp и при постоянном объеме Cv имеет вид
Cp - Cv = R (11)
Молярная теплоемкость идеального газа при постоянном объеме без учета энергии колебательного движения, т.е. при сравнительно невысоких температурах, равна:
• Для одноатомных молекул
Cv = 3/2R (12)
• Для двухатомных и линейных многоатомных молекул
Cv = 5/2R (13)
• Для нелинейных трехатомных и многоатомных молекул
Cv = 3R (14)
Температурная зависимость изобарных молярных теплоемкостей веществ, участвующих в реакции, определяется формулой
Ср = a + bT + c¢/T2, (15)
где a, b, c' – эмпирические коэффициенты, постоянные для данного вещества в определенном интервале температур.
 2015-07-03
2015-07-03 1371
1371








