В клинической биохимии анализ индивидуальных белков человека используется для установления вида патологического процесса (дистрофии, опухолевый рост, воспаление) и определения пораженного органа (инфаркт миокарда);
- установления природы патологии, например, при диагностике энзимопатий, инфекционных (гепатит) и других заболеваний;
- оценки течения различных физиологических процессов (беременность, развитие иммунной системы) и обнаружения осложнений в их течении (патология беременности).
В области разработки лекарств основной проблемой, как правило, является увеличение или уменьшение активности белков, поэтому необходим некоторый метод, позволяющий регулировать специфическую активность. 2Д электрофорез является основным средством изучения воздействия лекарств на протеом, или на совокупность всех белков органа. Как правило новые лекарства тестируются с помощью 2Д электрофореза, на накопление их в критических органах, например, в печени.
Пример 1. Лекарство ловастатин, понижающее уровень холестерола в крови. Специфика его действия заключается в ингибировании HMG-кофермент А редуктазы. Однако, при анализе эффекта, которое оказывает это лекарство в комбинации с другими средствами, понижающими холестерол, было найдено, что количество белка HMG-Кофермент-A синтазы значительно повышается, в то время как количество других белков уменьшаются. Позднее обнаружили, что основное действие изучаемого лекарства заключается не в прямом ингибировании синтеза холестерола, а в повышении активности другого белка, липопротеинового рецептора, который удаляет из крови холестерин.
Пример 2. Превентивное лекарство против рака олтипраз повышает экспрессию ряда белков, включая афлатоксин В1 альдегидредуктазу, который разрушает один из натуральных канцерогенов. Предполагалось, что эффект имеет место в эндоплазматическом ретикулуме. При анализе 2Д геля, однако, выяснилось, что большинство изменений происходит в растворимой и митохондриальной фракциях клетки. Кроме этого, при сравнении экстрактов печени самок и самцов, экспрессия более трети белков отличалась в количестве. Следует заметить, что почти все эти различия регулируются на гормональном эпигенетическом уровне и не обусловлены наличием Х или У хромосомы.
Эти данные свидетельствуют о том, что экспрессия генов в тканях очень пластична, отвечает на воздействия большого числа факторов и почти всегда включает не один или два, а много генов. 2Д электрофорез идеально подходит для изучения подобных динамических изменений.
Как правило, результаты 2Д коррелируют с известными механизмами функционирования белков. Так, если лекарство усиливает пролиферацию в пероксисомах по данным электронной микроскопии, то и на 2Д электрофорезе будет наблюдаться увеличение количества белков, характерных для этого типа органелл. Подобные структурно-функциональные взаимодействия означают, что идентификация белков-мишеней для нового лекарственного средства может помочь открыть механизмы функционирования этих белков.
Еще одна важная функция 2Д методов в клинической протеомике это поиск новых белков-маркеров заболеваний, в частности, онко-маркеров. Отмеченные в таблице 1 потенциальные маркеры рака простаты представляют особый интерес по разным причинам. Например, тимозин бета-15 может определяться в моче и, по-видимому, имеет прямое отношение к молекулярным механизмам злокачественного перерождения клеток. Соответственно, ген тимозина бета-15 и его продукты могут стать не только диагностическими маркерами, но и в перспективе мишенями для различных воздействий с целью подавления опухолевого роста.
Таблица 1.
| Название маркера | Значимость для диагностики рака простаты (РП) |
| 1. Белок AGR2 (AGR2) | Секреторный белок, андроген-индуцируемый, обнаружен в РП, гиперэксперессия в 89% случаев РП. Обнаруживается при других опухолях |
| 2. Простат-специфический мембранный антиген | Маркер с прогностической значимостью. Высокий уровень коррелирует со злокачественностью и метастазированием, но определяется и при аденоме |
| 3. Тимозин бета 15 | По иммуногистохимии – маркер с прогностической значимостью «Мочевой» маркер, что перспективно при организации скрининга Обнаруживается при других злокачественных опухолях. |
| 4. Белок Р63 | По иммуногистохимии – маркер с прогностической значимостью. |
| 5. Рацемаза (alpha-methylacyl CoA racemase, AMACR) | По иммуногистохимии – маркер с прогностической значимостью. |
| 6. Антиген простатных стволовых клеток (Prostate stem cell antigen, PSCA) | Маркер клеточных поверхностей, показана гиперэкспрессия гена при РП до 80%; высок уровень экспрессии при метастазах РП |
| 7. Высокомолекулярный цитокератин 34betaE12 (High-molecular-weight keratin 34betaE12) | По иммуногистохимии – маркер с прогностической значимостью. |
Методы
Комплексное изучение «протеома» проводится методами и технологиями, направленными на одновременное разделение, а также последующую идентификацию и анализ всех белков, синтезирующихся в клетке или другом объекте (органе, организме).
1. Изоэлектрофокусированием (ИЭФ) называют разработанный в начале 60-х годов метод разделения белков под действием электрического поля в среде с градиентом pH, который создается специальными амфотерными веществами – «амфолитами», способными переносить ток (хорошая проводимость), а также создавать локально и поддерживать рН (хорошая буферная емкость). Появление наборов полиамино-поликарбоновых кислот (амфолинов) обеспечило высокую эффективность фракционирования белков с помощью ИЭФ, при этом разделение осуществлялось за счет различий в pI.
2. Среди множества электрофоретических методов разделения белков наибольшая эффективность оказалась у особой модификации метода Лэммли для вертикальных пластин с градиентом концентрации полиакриламидного геля, использующего ионный детергент – додецилсульфат Na (SDS). За счет гидрофобных взаимодействий, используемый детергент практически одинаково связывается с подавляющим большинством белков в соотношении 1.4 мг SDS на 1 мг белка. Огромный избыток полностью диссоциированных остатков сульфокислоты делает несущественной роль заряда самого белка. Электрофоретическая подвижность комплекса белок-SDS в градиентном геле оказывается линейно связана с десятичным логарифмом его молекулярной массы (Mm). Таким образом, эта система обеспечивает разделение белков по различиям в Mm.
3. Идентификация миросеквенированием основана на определении (расшифровке) части аминокислотной последовательности белка. Разработанные методы микросеквенирования позволяют работать с очень малыми количествами пептидов - вплоть до нанограммовых. Это важно, так как определение даже короткого фрагмента аминокислотной последовательности часто оказывается решающим для идентификации целого белка. В настоящее время возможно как проведение прямого N-концевого секвенирования белка, перенесенного на инертную мемебрану, так и секвенирование отдельных пепетидов, полученных из изучаемого белка после его ферментативного расщепления высокоэффективной жидкостной хроматографией. Микросеквенирование позволяет выявлять одиночные аминокислотные замены в анализируеемых белках.
4. Масс-спектрометрия устанавливает какие атомы входят в состав молекулы, какова структура их расположения и изотопный состав, а также какова масса молекулы. Существенное отличие масс-спектрометрии от других аналитических физико-химических методов состоит в том, что оптические, рентгеновские и другие методы детектируют излучение или поглощение энергии молекулами или атомами, а масс-спектрометрия имеет дело с самими частицами вещества. Масс-спектрометрия измеряет соотношение массы частицы к заряду. Для этого используются законы движения заряженных частиц материи в магнитном или электрическом поле. Различают несколько модификаций масс-спектрометрических методов:
· Мягкая матриксная ионизация (M atrix- A ssisted L aser D esorption/ I onization -MALDI) позволяет анализировать такие биополимеры, как полисахара, пептиды и макромолекулы, без риска повредить их структуру. Ионизация производится лазерным пучком, а матрикс используется для защиты молекул от разрушающего действия лазера. Матрикс состоит обычно из кристаллов кислот в смеси с органическим растворителем.
· Тандемная масс-спектрометрия (MS/MS) проводится на приборе, который объединяет несколько анализаторов, позволяющих последовательно изолировать один пептид, стабилизировать ионы, составляющие его и идентифицировать фрагменты. Используется в идентификации белковых пятен после 2Д электрофореза.
5. Капиллярный электрофорез - это метод анализа сложных смесей, использующий электрокинетические явления – электромиграцию ионов и других заряженных частиц и электроосмос – для разделения и определения компонентов. Эти явления возникают в растворах при помещении их в электрическое поле, преимущественно, высокого напряжения. Если раствор находится в тонком капилляре, например, в кварцевом, то электрическое поле, наложенное вдоль капилляра, вызывает в нем движение заряженных частиц и пассивный поток жидкости, в результате чего проба разделяется на индивидуальные компоненты. Модификацией метода является капиллярный электрофорез в чипах. Идентификация белков с помощью масс-спектрометрии может проводиться непосредственно после разделения.
6. Недавно был аннонсирован метод к апиллярного изоэлектрофокусирования. После изофокусирования в канале чипа, покрытого специальной пленкой, чип замораживался, пленка удалялась и содержимое канала подвергалось высушиванию при критической точке для предотвращения изменения позиции белковых пятен. После этого матрикс для MALDI добавлялся непосредственно к содержимому чипа. В результате одновременно удавалось считывать информацию о молекулярном весе и изоэлектрической точке данного пептида.
7. Двумерный электрофорез:
При исследовании белков методом 2Д электрофореза, целью исследования является:
· обеспечить воспроизводимое разделение основных известных белков, характерных для данной ткани;
· показать присутствие известных минорных белков;
· выявить и идентифицировать маркерные белки, характеризующих известные изменения в данной ткани.
Для достижения цели решают следующие задачи:
1) Все белки, содержащиеся в изучаемом образце, подвергаются солюбилизации и становятся объектами анализа;
2) Проводится аналитическое фракционирование по двум независимым друг от друга физико-химическим свойствам полипептидных цепей, отражающих особенности их первичной структуры - комбинированное использование – двумерный гель-электрофорез (2D):
· Изоэлектрическое фокусирование (ИЭФ), обеспечивает фракционирование по pI.
· Электрофорез в присутствии SDS (SDS-ЭФ) обеспечивает разделение по Mm.
3) Выявление белковых фракций после разделения с помощью высокочувствительных методов детекции белков (различные модификации масс-спектрометрии).
4) Стандартизированное описание белков на двумерных электрофореграммах в системе прямоугольных координат, в которых одна из координат являться функцией молекулярной массы, а другая – изоэлектрической точкой для каждого вида полипептидных цепей.



|
|
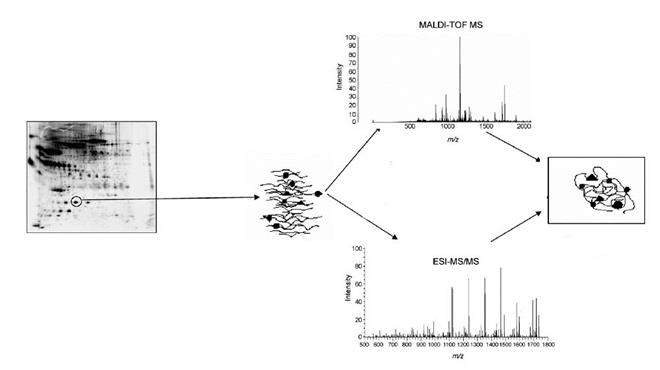 Рис.6. Схема протеомных исследований
Рис.6. Схема протеомных исследований Таблица 2.
| Процесс | Критические параметры |
| 1. Сбор и приготовление образцов | · Солюбилизация, · подбор оптимальных условий |
| 2. I направление (IEF) | · Повышение разрешения – использование иммобилиновых стрипов |
| 3. II направление (SDS PAGE) | · Повышение разрешения – увеличение размера геля |
| 4. Детекция белков (окраска и/или авторадиография, иммунодетекция) | · Чувствительность, · избирательность детекции/окраски |
| 5. Создание коллекций 2D гелей | · Компьютерный анализ изображений |
| 6. Вырезание отдельных белковых пятен | · Точность попадания |
| 7. Идентификация белков | · Масс-спектрометрия · Интерпретация данных |
| 8. Формирование банка данных | · Сравнение с другими базами данных |
| Создание протеома изучаемого объекта |
 2015-07-03
2015-07-03 5001
5001








