Возникновение возбуждения имеет свои особенности в волокнах рабочего миокарда и в волокнах водителей ритма.
 Волокна рабочего миокарда
Волокна рабочего миокарда
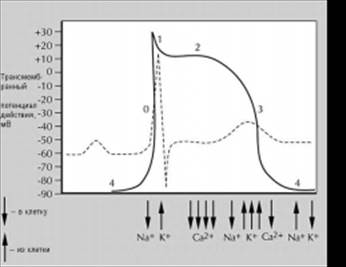
В потенциале действия сократительного кардиомиоцитов различают 5 фаз (рис):
Фаза 0 (деполяризации) - возникает за счёт быстрого входа ионов натрия внутрь клетки, что вызывает быстрое изменение трансмембранного потенциала (от -90мВ до +30мВ).
Фаза 1 - отражает раннюю быструю реполяризацию в результате транзиторного выхода калия из клетки.
Фаза 2 (плато) - опосредована медленными кальциевыми каналами, через которые ионы кальция проникают в клетку. Вход кальция внутрь клетки препятствует реполяризации, таким образом удлиняя продолжительность потенциала действия и рефрактерного периода.
Фаза 3 представляет собой период быстрой конечной реполяризации, в ходе которой происходит выход ионов калия из клетки, а также замедление входа ионов кальция и натрия внутрь клетки.
Фаза 4 (фаза покоя) является интервалом между окончанием реполяризации и началом следующего потенциала действия. В состоянии покоя деполяризующие и реполяризующие токи находятся в равновесии.
Длительность потенциала действия кардиомиоцитов составляет 200-400 мс, т. е. более чем в 100 раз превышает соответствующую величину для скелетных мышц и нервных волокон. Позитивная деполяризация, возникшая в одной клетке приводит к распространению возбуждения на остальные клетки. Таким образом электрический импульс распространяется по всему сердцу. Скорость деполяризации определяет скорость проведения электрического импульса по сердечной мышце.
Определенным фазам цикла возбуждения в сердце, как и в других возбудимых тканях, соответствуют периоды невозбудимости (абсолютной рефрактерности) и сниженной возбудимости (относительной рефрактерности). Длительный рефрактерный период, с одной стороны, предохраняет миокард от слишком быстрого повторного возбуждения, которое могло бы нарушить нагнетательную функцию сердца, а с другой, препятствует круговому движению возбуждения по миокарду, которое привело бы к нарушению ритмичного чередования сокращения и расслабления. В норме рефрактерный период клеток миокарда больше, чем время распространения возбуждения по предсердиям или желудочкам. Поэтому после того, как волна возбуждения из СА-узла или гетеротопного очага охватит полностью весь миокард, она угасает и обратный вход этой волны невозможен, так как все сердце находится в состоянии рефрактерности.
Существует зависимость между длительностью потенциала действия и его частотой. Потенциал действия, возникающий сразу после окончания периода относительной рефрактерности предыдущего цикла возбуждения, характеризуется обычной крутизной переднего фронта и амплитудой. Однако длительность потенциала действия значительно уменьшена. Таким образом, существует тесная связь между продолжительностью потенциала действия и длительностью интервала между началом этого потенциала действия и концом предыдущего, т. е. между длительностью и его частотой. Описанный эффект обусловлен главным образом тем, что проницаемость для K + после окончания реполяризации еще повышена и лишь через некоторое время постепенно возвращается к исходному уровню. В том случае, если интервал между потенциалами действия мал, это повышение проницаемости для К + приводит к ускорению реполяризации в очередных циклах возбуждения.
Волокна водителей ритма и проводящей системы
Клетки рабочего миокарда предсердий и желудочков не обладают автоматизмом. Потенциалы действия в них возникают лишь под влиянием распространяющегося возбуждения: от возбужденных участков к невозбужденным течет ток, вызывающий деполяризацию последних. Когда в результате этой деполяризации мембранный потенциал достигает критического (порогового) значения, возникает потенциал действия.
 Клетки сердца, обладающие автоматизмом, спонтанно деполяризуются до критического уровня. В таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации (см. рис), начинающаяся сразу по достижении максимального диастолического потенциала и приводящая к снижению мембранного потенциала до порогового уровня и возникновению потенциала действия. В отличие от потенциала действия медленная диастолическая деполяризация (пейсмекерный потенциал, препотенциал) - это местное, нераспространяющееся возбуждение.
Клетки сердца, обладающие автоматизмом, спонтанно деполяризуются до критического уровня. В таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации (см. рис), начинающаяся сразу по достижении максимального диастолического потенциала и приводящая к снижению мембранного потенциала до порогового уровня и возникновению потенциала действия. В отличие от потенциала действия медленная диастолическая деполяризация (пейсмекерный потенциал, препотенциал) - это местное, нераспространяющееся возбуждение.
Медленная диастолическая деполяризация в синоатриальном узле обусловлена иными механизмами, нежели в желудочковой проводящей системе. Во-первых, для клеток СА-узла характерен более высокий постоянный фоновый натриевый ток, препятствующий достижению равновесного калиевого потенциала Ек. В связи с этим мембранный потенциал этих клеток постоянно низок, и быстрые натриевые каналы (даже если они в этих клетках имеются) инактивированы. Во время фазы реполяризации потенциала действия проницаемость мембраны для калия увеличивается, становясь выше уровня покоя. В результате мембранный потенциал приближается к равновесному калиевому потенциалу Ек и достигает максимального диастолического значения. Затем проницаемость для K + постепенно снижается до уровня покоя и мембранный потенциал все более отличается от Ек, достигая в конечном счете уровня, при котором активируется медленный входящий ток, отвечающий за передний фронт потенциала действия в данных клетках (таким образом, их потенциалы действия сходны с потенциалом действия деполяризованных клеток желудочков). Сходные механизмы действуют и в атрио-вентрикулярном (АВ) узле.
В норме ритм сердечных сокращений задают лишь несколько клеток синоатриального узла - так называемые истинные водители ритма. Все остальные клетки проводящей системы разряжаются, как и рабочий миокард, под действием распространяющегося возбуждения. Эти клетки называют латентными (скрытыми, потенциальными) водителями ритма. Потенциал действия в них возникает под влиянием токов от возбужденных участков до того, как в результате их собственной медленной диастолической деполяризации их мембранный потенциал достигнет порогового уровня. В связи с тем, что в латентных водителях ритма медленная диастолическая деполяризация позже достигает порогового уровня, частота их разрядов ниже.
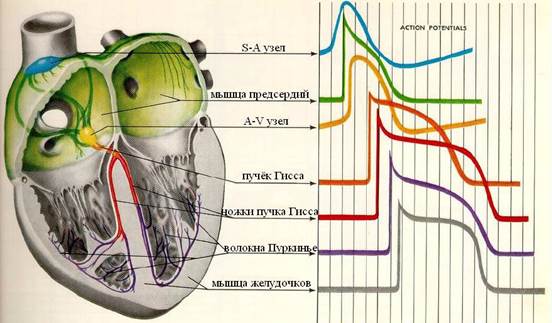 В различных участках сердца потенциалы действия характеризуются определенными особенностями. Потенциал действия для некоторых отделов сердца приведены на рис:
В различных участках сердца потенциалы действия характеризуются определенными особенностями. Потенциал действия для некоторых отделов сердца приведены на рис:
Интервал от нулевой вертикальной линии до переднего фронта потенциала действия соответствует времени задержки возбуждения того или иного отдела по отношению к синусному узлу. По мере удаления от синусного узла того или иного отдела проводящей системы наклон кривой медленной диастолической деполяризации клеток становится все менее крутым. Крутизна переднего фронта и амплитуда потенциала действия в клетках СА- и АВ-узлов существенно ниже, чем в остальных отделах проводящей системы. Длительность плато и соответственно рефрактерного периода в рабочих клетках предсердий меньше, чем в миокарде желудочков. Окончания волокон Пуркинье обладают весьма длительными потенциалами действия и поэтому играют роль "частотного фильтра", препятствующего слишком частым сокращениям желудочков при чрезмерно высокой частоте возбуждения предсердий.
Связь между возбуждением и сокращением (электромеханическое сопряжение). Сокращение сердца, как и скелетных мышц, запускается потенциалом действия. Тем не менее временные соотношения между возбуждением и сокращением в этих двух типах мышц различны. Длительность потенциала действия скелетных мышц составляет лишь несколько миллисекунд, и сокращение их начинается тогда, когда возбуждение уже почти закончилось. В миокарде же возбуждение и сокращение в значительной степени перекрываются во времени. Потенциал действия клеток миокарда заканчивается только после начала фазы расслабления. Поскольку последующее сокращение может возникнуть лишь в результате очередного возбуждения, а это возбуждение в свою очередь возможно только по окончании периода абсолютной рефрактерности предшествующего потенциала действия, сердечная мышца в отличие от скелетной не может отвечать на частые раздражения суммацией одиночных сокращений, или тетанусом.
Это свойство миокарда - неспособность к состоянию тетануса -- имеет большое значение для нагнетательной функции сердца; тетаническое сокращение, продолжающееся дольше периода изгнания крови, препятствовало бы наполнению сердца. Вместе с тем сократимость сердца не может регулироваться путем суммации одиночных сокращений, как это происходит в скелетных мышцах, сила сокращений которых в результате такой суммации зависит от частоты потенциалов действия. Сократимость миокарда в отличие от скелетных мышц не может изменяться и путем включения различного числа двигательных единиц, так как миокард представляет собой функциональный синцитий, в каждом сокращении которого участвуют все волокна (закон «все или ничего»). Эти несколько невыгодные с физиологической точки зрения особенности компенсируются тем, что в миокарде гораздо более развит механизм регуляции сократимости путем изменения процессов возбуждения либо за счет прямого влияния на электромеханическое сопряжение.
Механизм электромеханического сопряжения в миокарде. У человека и млекопитающих структуры, которые отвечают за электромеханическое сопряжение в скелетных мышцах, в основном имеются и в волокнах сердца. Для миокарда характерна система поперечных трубочек (Т-система); особенно хорошо она развита в желудочках, где эти трубочки образуют продольные ответвления. Напротив, система продольных трубочек, служащих внутриклеточным резервуаром Са2+, в мышце сердца развита в меньшей степени, чем в скелетных мышцах. Как структурные, так и функциональные особенности миокарда свидетельствуют в пользу тесной взаимосвязи между внутриклеточными депо Са2+ и внеклеточной средой. Ключевым событием в сокращении служит вход в клетку Са2+ во время потенциала действия. Значение этого кальциевого тока состоит не только в том, что он увеличивает длительность потенциала действия и вследствие этого рефрактерного периода: перемещение кальция из наружной среды в клетку создает условия для регуляции силы сокращения. Однако количество кальция, входящего во время ПД, явно недостаточно для прямой активации сократительного аппарата; очевидно, большую роль играет выброс Са2+ из внутриклеточных депо, запускаемый входом Са2+ извне. Кроме того, входящие в клетку ионы пополняет запасы Са2+, обеспечивая последующие сокращения.
Таким образом, потенциал действия влияет на сократимость по меньшей мере двумя путями. Он - играет роль пускового механизма («триггерное действие»), вызывающего сокращение путем высвобождения Са2+ (преимущественно из внутриклеточных депо); - обеспечивает пополнение внутриклеточных запасов Са2+ в фазе расслабления, необходимое для последующих сокращений.
Механизмы регуляции сокращений. Целый ряд факторов оказывает косвенное влияние на сокращение миокарда, изменяя длительность потенциала действия и тем самым величину входящего тока Са2+. Примеры такого влияния -- снижение силы сокращений вследствие укорочения ПД при повышении внеклеточной концентрации К+ или действии ацетилхолина и усиление сокращений в результате удлинения ПД при охлаждении. Увеличение частоты потенциалов действия влияет на сократимость так же, как и повышение их длительности (ритмоинотропная зависимость, усиление сокращений при нанесении парных стимулов, постэкстрасистолическая потенциация). Так называемый феномен лестницы (нарастание силы сокращений при их возобновлении после временной остановки) также связан с увеличением внутриклеточной фракции Са2+.
Учитывая эти особенности сердечной мышцы, не приходится удивляться тому, что сила сокращений сердца быстро изменяется при изменении содержания Са2+ во внеклеточной жидкости. Удаление Са2+из внешней среды приводит к полному разобщению электромеханического сопряжения; потенциал действия при этом остается почти неизменным, но сокращений не происходит.
Ряд веществ, блокирующих вход Са2+ во время потенциала действия, оказывает такой же эффект, как и удаление кальция из внешней среды. К таким веществам относятся так называемые антагонисты кальция (верапамил, нифедипин, дилтиазем) Напротив, при повышении внеклеточной концентрации Са2+ или при действии веществ, увеличивающих вход этого иона во время потенциала действия (адреналин, норадреналин), сократимость сердца увеличивается. В клинике для усиления сердечных сокращений используют так называемые сердечные гликозиды (препараты наперстянки, строфанта и т. д.).
В соответствии с современными представлениями сердечные гликозиды повышают силу сокращений миокарда преимущественно путем подавления Nа+/К+-АТФазы (натриевого насоса), что приводит к повышению внутриклеточной концентрации Nа +. В результате снижается интенсивность обмена внутриклеточного Са2+ на внеклеточный Nа+, зависящего от трансмембранного градиента Nа, и Са2+ накапливается в клетке. Это дополнительное количество Са2+ запасается в депо и может быть использовано для активации сократительного аппарата
Сердечный цикл - совокупность электрических, механических и биохимических процессов, происходящих в сердце в течение одного полного цикла сокращения и расслабления.
Сердце человека в среднем сокращается 70 -75 раз в 1 мин, при этом одно сокращение длится 0,9 - 0,8 с. В цикле сокращений сердца различают три фазы: систолу предсердий (ее длительность 0,1 с), систолу желудочков (ее длительность 0,3 - 0,4 с) и общую паузу (период, в течение которого одновременно расслаблены и предсердия, и желудочки,-0,4 - 0,5 с).
Сокращение сердца начинается с сокращения предсердий. В момент систолы предсердий кровь из них проталкивается в желудочки через открытые атриовентрикулярные клапаны. Затем сокращаются желудочки. Предсердия во время систолы желудочков расслаблены, т. е. находятся в состоянии диастолы. В этот период атриовентрикулярные клапаны закрываются под давлением крови со стороны желудочков, а полулунные клапаны раскрываются и кровь выбрасывается в аорту и легочные артерии.
В систоле желудочков различают две фазы: фазу напряжения - период, в течение которого давление крови в желудочках достигает максимальной величины, и фазу изгнания - время, в течение которого открываются полулунные клапаны и кровь выбрасывается в сосуды. После систолы желудочков наступает их расслабление -диастола, которая длится 0,5 с. В конце диастолы желудочков начинается систола предсердий. В самом начале паузы полулунные клапаны захлопываются под давлением крови в артериальных сосудах. Во время паузы предсердия и желудочки наполняются новой порцией крови, поступающей из вен.
 2015-07-03
2015-07-03 2149
2149