· Скорость химической реакции - скорость изменения количества (молярной концентрации) одного из реагирующих веществ.
Скорость реакции определяется изменением количества вещества в единице объема за единицу времени, т.е. изменением концентрации D c вещества за единицу времени D t:
vср = ± Dc / Dt = ± (c2-c1) / (t2-t1),
где c1 и c2 - молярные концентрации вещества в моменты времени t1 и t2, соответственно; знак "+" ставится, если скорость определяется по продукту реакции, знак "–" - по исходному веществу.
Отношение D c / Dt характеризует скорость за какой-то промежуток времени и называется средней скоростью. Чем меньше интервал D t и изменение D c, тем точнее отношение D c /Dt соответствует истинной (мгновенной) скорости в данный момент. Математически это представляется в виде производной от концентрации по времени:
vист = ± dc / dt.
На скорость химической реакции, кроме природы реагирующих веществ, влияют следующие факторы:
- концентрация реагентов (закон действующих масс);
- температура (правило Вант-Гоффа);
- наличие катализатора, его природа и концентрация.
В случае гетерогенной реакции, т.е. реакции, происходящей на границе раздела фаз между реагентами, находящимися в разных агрегатных состояниях (твердое-жидкое, твердое-газообразное и т.п.), количество реагирующего вещества относят к единице площади S межфазной поверхности:
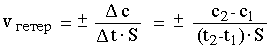
Для сложной реакции, проходящей через несколько элементарных стадий, суммарная скорость определяется скоростью самой медленной стадии.
 2015-07-03
2015-07-03 289
289








