Пример 1. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 -)= 7,2.
Решение:
рН буферного раствора равно: рН = рКа + lg 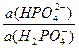
Определяем ионную силу раствора.
KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42-
0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
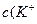 )=
)= 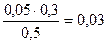 моль/л c(Na
моль/л c(Na  )=
)= 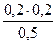 = 0,08моль/л
= 0,08моль/л
c(H2PO4-)= 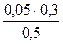 = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)= 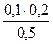 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По таблице находим коэффициенты активности f ионов. 

f(H2PO4-) =0,81. f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 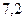 +lg
+lg 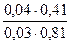 = 7,03.
= 7,03.
Пример 2 Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1,
а f(NH4+) = 0,81 в соответствии с ионной силой.
pН данной буферной системы равно: рН = рКа(NH4+) + lg 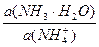
pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 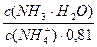
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 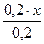 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)= 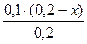 =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54 = 9,24 + lg 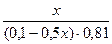 lg
lg 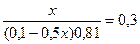
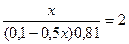 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 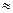 90мл.
90мл.
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Пример 3 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
Решение:
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 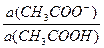
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 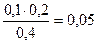 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН = 4,76 + lg 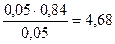
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
0,02 0,01 0,01 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 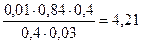
Буферная ёмкость по кислоте равна: Bк = 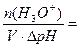
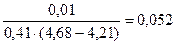 моль/л.
моль/л.
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH + OH- = CH3COO- + H2O
0,02 0,01 0,01 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало:
0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 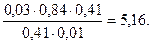
Буферная ёмкость по щёлочи равна: Вщ = 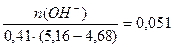 моль/л.
моль/л.
 2015-07-03
2015-07-03 7821
7821
