Zi(r, t) – интенсивное свойство
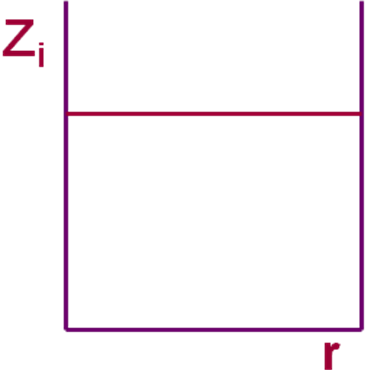
Однородные
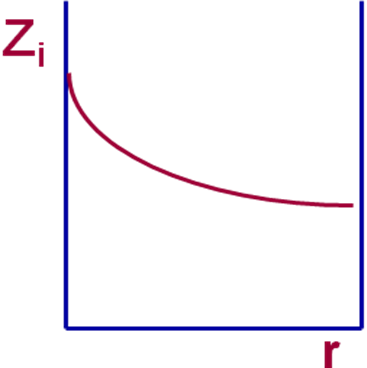
Непрерывные
Прирывные
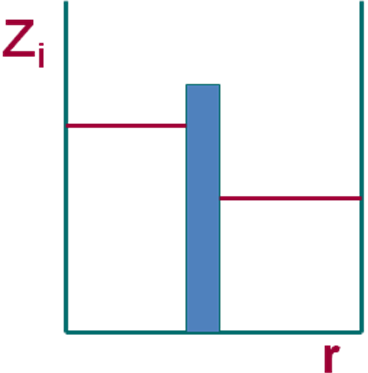
Однородные – такие системы в которых интенсивные свойства не меняются от точки к точке системы. (пример такой системы это система в которой протекают химические реакции, но свойства таких систем во времени будут меняться со временем, будут нестационарными)
Непрерывные – такие системы, в которых интенсивное свойство является непрерывной функцией от координат
Прерывные – системы, которые представляют собой одну или несколько однородных систем, которые разделены специальным устройством (вентель)
------------------------------------------------------------------------------------------------------------------
В неравновесной термодинамике изучают три типа систем: однородные, неоднородные, непрерывные (рис.1). Для этих систем характерно качественно различное распределение интенсивных свойств Zi по пространственной координате r.

В однородных системах интенсивные свойства не изменяются по координате. Однако, однородность систем не говорит об их внутренней равновесности, поскольку в общем случае т/д свойства зависят не только от координаты, но и от времени Zi =f(r,t). Однородные системы, будучи изолированы от окружающей среды, способны проявлять признаки нестационарности, т.е. изменять свои свойства во времени. Эволюция любой изолированной системы к равновесию называется релаксацией, а протекающие в ней процессы – релаксационными. Отличительной чертой релаксационных процессов является то, что они не требуют для своего протекания макроскопической неоднородности и не обладают характерной для явлений переноса пространственной направленностью. Поэтому они получили название скалярных. К основным скалярным процессам относятся хим. реакции и структурная релаксация.
В непрерывных системах интенсивное свойство является непрерывной функцией пространственных координат. Пример непрерывной системы – металлический стержень, концы которого поддерживаются при двух разлихных температурах.
Прерывные системы состоят из двух или более однородных областей (подсистем) I и II, интенсивность взаимодействия между которыми регулирует некоторое устройство, называемое вентилем III. В качестве вентиля может выступать малое отверстие, капилляр, пучок капилляра, пористая или сплошная перегородка, граница раздела фаз и т.д.
Используемый в процессах разделения вентиль в виде перегородки малой толщины по сравнению с его остальными геометрическими размерами называется мембраной. Часто в качестве синонима систем употребляют термин «мембранные системы».
3. Сформулировать основные постулаты термодинамики необратимых процессов
Основные из положений, дополняющих положения классической термодинамики, являются следующие:-возможность разбиения процессов, происходящих в системе, на внешние (контролируемые внешними к системе силами,обозначаемые deS) и внутренние («самопроизвольные», обозначаемые diS) и как следствие возможность раздельного рассмотрения в общем изменении энтропии рассматриваемой системы изменений, связанных с действием внешних и внутренних термодинамических сил и процессов. При этом dS ≥ 0, а dS = diS + deS;-зависимость энтропии вне равновесия от тех же величин и переменных, что и в состоянии равновесия (Постулат о существовании локальных величин).При этом diS ≥ 0;-возможность сопряжения (взаимовлияния) различных термодинамических процессов, «самопроизвольно» и одновременно протекающих внутри системы; -принципиальная важность понятия устойчивости неравновесного состояния системы.
1. Локальное термодинамическое равновесие.
Термодинамическое равновесие реализуется только в физически бесконечно малых частях системы. Наличие локального термодинамического равновесия означает возможность применения любых равновесных соотношений в заданной точке неравновесной сплошной среды. Типы неравновесных систем
Zi(t,r) − интенсивное свойство. 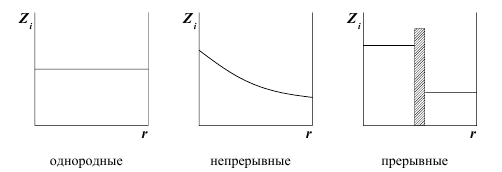
Фундаментальное уравнение Гиббса в глобальном виде:
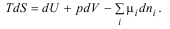
В локальном виде на единицу массы:
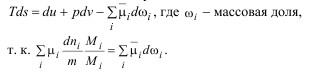
В локальном виде на единицу объёма: 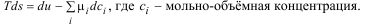
Для экстенсивной величины B справедливо тождество: 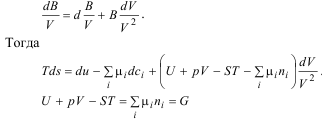
2. Вся потерянная работа переходит в теплоту.
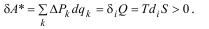
S – единственная функция, с помощью которой можно охарактеризовать все
многообразие неравновесных процессов. 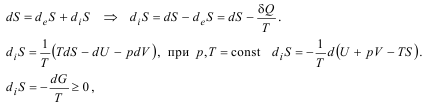
возникновение энтропии происходит за счет уменьшения энергии Гиббса.
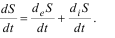
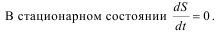
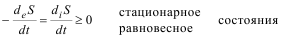
Стационарное состояние насыщено энтропией.
Локальная функция диссипации: 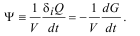
Локальная скорость возникновения (производство) энтропии:
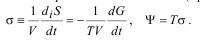
Подставим δA*=δiQ в Ψ при ∆Pk =const:
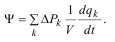
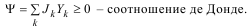
Для самопроизвольного протекания суммарного процесса не накладывается ограничений на отдельные члены суммы, т.е. некоторые из них могут быть отрицательными. Это значит, что в совокупности процессов могут протекать процессы, которые сами по себе термодинамически запрещены.
Термодинамическое сопряжение процес сов
 без катализатора скорость мала
без катализатора скорость мала
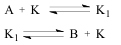 K1 – каталитический интермедиат
K1 – каталитический интермедиат
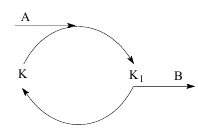

Самопроизвольно протекающую реакцию называют сопрягающей –реакция б; реакцию а-сопряженной.
A – актор (общее для реакций вещество),
B – индуктор (вещество, реагирующее с актором),
С – акцептор.
3. Взаимосвязь потоков и сил.
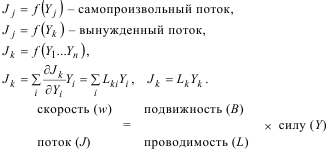
Принцип Кюри: в изотропной системе в линейной области потоки и термодинамические силы различной тензорной размерности не могут быть связаны друг с другом.
4 - Дать определение понятию «локальная величина»
Согласно 2-му постулату термодинамики необратимых процессов можно оперировать локальными величинами. Локальными макроскопическими величинами называются величины, отнесенные к физически бесконечно малым частям системы. Впервые понятие «локальной величины» ввел Лоуренц (применимо к объемам).
Физически бесконечно малая величина – конечная, но относительно малая часть целого. Применимо для экстенсивных величин.
Физически бесконечно малый объем – объем, который велик по сравнению с расстоянием между частями, но очень мал по сравнению с макроскопическими неоднородностями системы, мал по отношению к размерам всей системы.
Именно в таких бесконечно малых системах согласно 2-му постулату термодинамики может реализовываться состояние равновесия – называемое локальным.
Локальное т/д равновесие – реализуется только в физически бесконечно малых частях системы. В целом система не равновесна. При этом макроскопические величины, которые характеризуют систему в целом, будут функциями координат и времени.
Процессы, которые нарушают локальное равновесие, называют возмущающими, а процессы, которые стремятся привести систему в состояние равновесия – релаксационные.
Время наступления локального равновесия очень мало. Для газов 1,6·10-10с, для жидкостей - 1·10-13с, поэтому установление локального процесса наблюдается почти всегда и практически для всех неравновесных систем. Исключение – процессы, скорость протекания которых больше, чем скорость наступления локального равновесия.
Для локальных частей системы возможно использование всех законов, принципов и выражение классических т/д.
5..Охарактеризуйте изменение энтропии открытой системы
Согласно I постулату, общее изменение энтропии в открытой системе обусловлено изменением энтропии внутри системы diS и изменение энтропии за счет обмена с внешней средой deS. Обе составляющие независимы друг от друга.
dS = deS + diS
Если diS = 0 – изменения обратимы.
Если diS > 0 – изменения необратимы.
Если deS=0, то
dS = diS³ 0 – изолированные системы.
dS = deS + diS – должно и будет выполнятся в любой момент времени.
dS/dt = deS/dt + diS/dt
dS/dt – скорость общего изменения энтропии системы
deS/dt – скорость обмена энтропии системой и окружающей средой
diS/dt – скорость возникновения (производства) энтропии внутри самой системы.
Разделение общего изменения энтропии на две составляющие является принципиальным отличием классической термодинамики от неравновесной термодинамики.
1. dS/dt > 0
deS/dt > 0 или deS/dt < 0, но |deS/dt| < diS/dt
2. dS/dt < 0
deS/dt < 0 и |deS/dt| > diS/dt
3. dS/dt = 0
deS/dt < 0 и |deS/dt| = diS/dt
Стационарное состояние
dS/dt = 0
deS/dt < 0 и |deS/dt| = diS/dt
dS/dt = deS/dt + diS/dt = 0
dS = deS + diS = 0
Производство энтропии компенсируется оттком энтропии во внешнею среду.
Энтропию стационарного состояния нельзя повысить.
Стационарное состояние «насыщено» энтропией.
---------------------------------------------------------------------------------------------------------------------
Изменение энтропии открытых систем (системы, которые обмениваются с внешней средой и энергией и веществом) происходит либо за счет ее увеличения вследствие самопроизвольного протекания термодинамически необратимых процессов внутри самой системы (diS), либо за счет процессов обмена системы с внешней средой (deS). Для химически реакционноспособных систем изменение diS может быть вызвано, например, спонтанным протеканием реакций внутри системы, в то время как deS – подводом или отводом из системы теплоты и / или некоторых реагентов. В термодинамике необратимых процессов постулируют, что упомянутые составляющие diS и deS являются независимыми, а общее изменение энтропии открытой системы (dS) равно их сумме: dS = diS + deS.Если внутри системы протекают только термодинамически обратимые изменения, то они не сопровождаются увеличением энтропии и diS = 0. Во всех случаях наличия необратимых изменений diS > 0. Очевидно, что для изолированных систем deS ≡ 0 и выражение для dS сводится к dS = diS ≥ 0.Это соответствует классической формулировке второго начала термодинамики для изолированных систем. В общем случае если в какой-нибудь части открытой системы с пространственной координатой одновременно протекают различные необратимые процессы с общей плотностью приращения энтропии diS (t) > 0 в данной точке пространства, то общее приращение энтропии всей системы в целом за счет внутренних процессов выражается интегралом.
6. Каким образом в термодинамике необратимых процессов вводится новая переменная – время? Привести пример.
Общее производство энтропии состоит из суммы энтропии внутри и снаружи системы и выражается формулой:
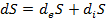 , где
, где 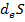 - изменение энтропии снаружи системы,
- изменение энтропии снаружи системы, 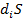 – изменение энтропии внутри системы.
– изменение энтропии внутри системы.
Продифференцировав уравнение вводится новая переменная – время. Уравнение принимает вид:
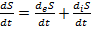
7. Охарактеризуйте скорость изменения энтропии открытой системы







 2015-07-02
2015-07-02 1156
1156
