В системах, где протекают химические реакции, важной величиной является глубина протекания каждой из реакций. Для характеристики глубины протекания реакции вводят специальный параметр, который называется химическая переменная. Для её определения рассмотрим систему, в которой происходит только одна химическая реакция:
При такой записи химических уравнений значения стехиометрических коэффициентов положительны у продуктов реакции и отрицательны у исходных веществ.
Из стехиометрического уравнения химической реакции следует, что изменения количеств всех веществ, принимающих участие в реакции, связаны друг с другом. Действительно, пусть количество вещества А к в результате протекания реакции на некоторую глубину изменилось на ∆n(A к). Тогда изменение количества любого, например, i-того, вещества произойдет на величину ∆n(A і), равную
Из этого уравнения видно, что
Следовательно, отношение изменения количества любого вещества, участвующего в реакции, к стехиометрическому коэффициенту этого же вещества в уравнении реакции не зависит от природы вещества, а характеризует только глубину протекания реакции и называется химической переменной ξ:
(2.1)
Размерность величины ξ – моль. Для описания состояния системы обычно полагают, что величина ξ в начальном состоянии равна нулю. В дальнейшем величина ξ может принимать как положительные значения, если реакция протекает в прямом направлении, так и отрицательные, если реакция идет в обратном направлении. Если изменение ξ равно единице, то это означает, что количество актов реакции равно числу Авогадро. Масштаб изменения величины ξ определяется количеством веществ в системе в исходном состоянии. Из (2.1) легко получить выражения для количества любого вещества в системе в любой момент времени. Действительно, учитывая, что
получаем
Наряду с (2.2) часто будет использоваться и дифференциальное уравнение
Если в системе протекает несколько (R) химических линейно независимых реакций,
(где i – номер компонента, j – номер реакции, νij– стехиометрический коэффициент при i -м компоненте в химическом уравнении j -й реакции), то глубину протекания каждой из них можно охарактеризовать своим значением ξ j. Изменение количества i -го реагента по аналоги с (2.3) можно записать так:
Интегрируя (2.4.), получаем выражение для количества i -го компонента в системе:
Формула (2.5) очень удобна при термодинамических расчетах сложных систем со многими реакциями. С ее помощью легко учитывать, что один и тот же компонент с одних реакциях может быть исходным веществом, а в других – конечным.
Взаимосвязь химической переменной и скорости химической реакции:
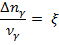
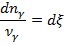
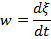
где w – cкорость химической реакции
9. Показать разницу между сохранением массы в закрытой и открытой системах.
В закрытых системах изменение массы может быть вызвано только протеканием одной химической реакции или нескольких химических реакций:
dmγ=νγMγdξ,
где: νγ– стехиометрический коэффициент компонента γ;
Mγ– молярная масса компонента γ;
ξ – степень полноты реакции (химическая переменная).
В свою очередь dξ = dmγ/νγM.γ
Это отношение изменения количества моль данного компонента в химической реакции к его стехеометрическому коэффициенту в уравнении реакции. ξ зависит от реакции и механизма и не зависит от природы вещества.
Рассмотрим реакцию образования аммиака (закрытая система):
N2+ 3H2→ 2NH3
Опираясь на выражение dξ = dmγ/νγMγ для данной реакции получим следующее
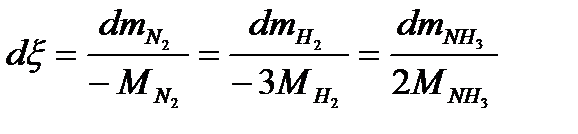 .
.
Стехеометрический коэффициент при записи выражения будет положительным для продуктов реакции и отрицательным для исходных веществ.
Запишим математическое выражение закона сохранения массы для данной системы: 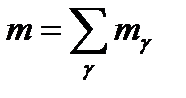
Исходя из этого можно сделать вывод что изменение массы в данной системе равно 0.
Запишем его в дифференциальном виде через химическую переменную:
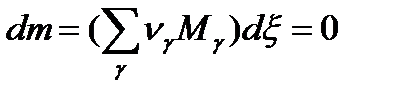 В стехиометрическом виде это выражение будет выглядеть так:
В стехиометрическом виде это выражение будет выглядеть так: 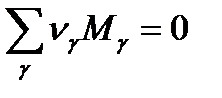
Это выражение является стехиометрическим уравнением химической реакции.
Если в системе протекает одновременно r (несколько) реакций, то это уравнение будет иметь следующий вид:
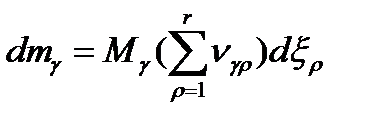
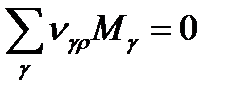
Где: ρ- индекс, показывающий порядковый номер реакции.
r- общее число химических реакций в системе.
В открытой системе общее изменение массы делится на два компонента:
· Изменение внутри системы(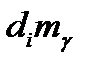 );
);
· Изменение за счет обмена с окружающей средой (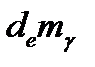 ).
).
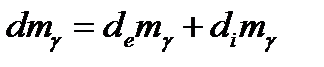 Если представить, что
Если представить, что 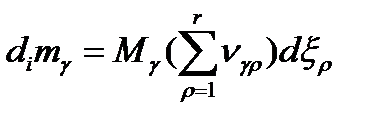 и подставить в предыдущее выражение получим:
и подставить в предыдущее выражение получим:
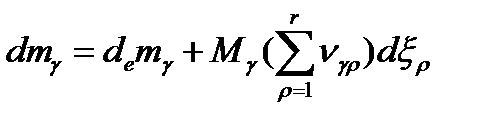 Зная,что
Зная,что 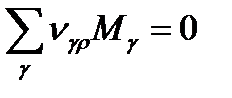 , получим:
, получим: 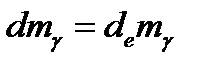
Из всего этого видно,что изменение массы в открытой системе будет определяться только изменением массы за счет обмена с окружающей средой.
10. Охарактеризуйте скорость изменения энтропии для стационарного состояния неравновесной системы.
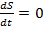 ,
, 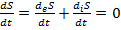 ,
, 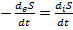
Энтропию стационарного состояния нельзя повысить. Стационарное состояние «насыщено» энтропией. Стационарные процессы в изолированной системе не реализуются.
11. Охарактеризовать производство энтропии для однородной гомогенной системы при наличии химических превращений
12. Охарактеризовать скорость производства энтропии для однородной гомогенной системы при наличии химических превращений.
Скорость производства энтропии в открытой системе при постоянных Т и р пропорциональна скорости уменьшения термодинамического потенциала Гиббса системы.
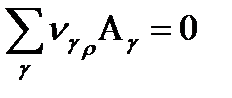 Если в такой системе протекает стехиометрическая реакция, которую можно представить в виде стехиометрического уравнения:
Если в такой системе протекает стехиометрическая реакция, которую можно представить в виде стехиометрического уравнения:
А- молекулярная формула данного компонента в общем случае
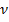 - стехиометрический коэффициент
- стехиометрический коэффициент
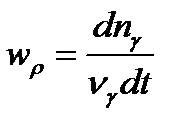
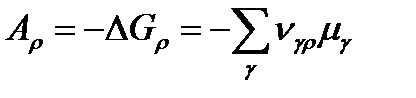
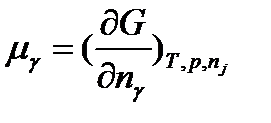
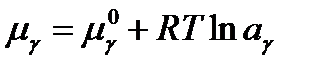
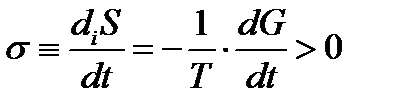
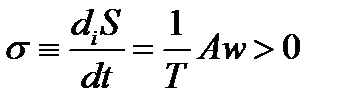
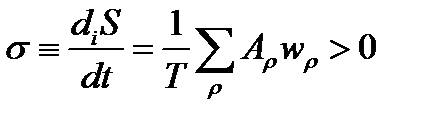
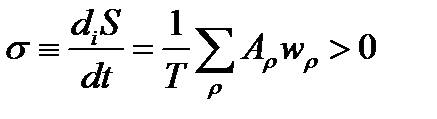
Скорость производства энтропии в стехиометрическом процессе пропорциональна произведению значений движущей силы процесса А и скорости реакции w
ИЛИ вариант 2
Неравновесные системы с изотропными и постоянными во времени температурой и давлением представляют собой простейший случай реальных неравновесных систем. Примерами таких систем являются открытые или замкнутые системы, где протекают неинтенсивные химические реакции, в которых молекулы исходных реагентов, продуктов и промежуточных соединений – интермедиатов – могут рассматриваться в качестве термализованных.
Если внутри открытой системы достигнуты изотропность и равновесие в отношении распределения температуры и давления (но не химического состава системы) и процессы обмена со средой протекают равновесно, то общее изменение энтропии такой системы, как было постулировано, описывается выражением
dS = diS + deS.
В условиях замкнутости системы (т. е. при отсутствии обмена веществом) deS описывает изменение энтропии открытой системы в результате ее равновесного теплообмена с окру-
жающей средой, т. е. deS = δQ / T. При этом
diS = dS – deS = dS – δQ / T. (1.2)
Величина diS соответствует самопроизвольному возрастании энтропии внутри системы за счет химических превращений веществ, находившихся исходно в неравновесном состоянии, и возможному совершению при этом работы. Будем полагать, что система совершает только механическую работу расширения δW = pdV. В этом случае согласно
δQ = dU + pdV, (1.3)
где dU – изменение внутренней энергии системы. Подставляя в выражение (1.2) соотношение (1.3), получаем
diS = (1 / T) (TdS – dU – pdV) (1.4)
или при фиксированных температуре и давлении
diS = –(1 / T) d(U + pV – TS).
Поскольку, по определению потенциала Гиббса,
G = U – TS + pV,
при фиксированной температуре и давлении выражение в скобках соответствует изменению термодинамического потенциала Гиббса:
d(U + pV – TS) = dG.
Отметим, что дифференциалы в выражении (1.4) записаны не через дифференциалы стандартных для потенциала G переменных р и Т, как это делают при рассмотрении термодинамического равновесия. Следовательно, при T, p = const
diS = –dG / T > 0. (1.5)
Выражение (1.5) остается в силе и в случае открытости системы, т. е. возможности дополнительного изменения ее потенциала Гиббса за счет притока или оттока вещества. Поэтому скорость производства энтропии за счет протекания внутренних необратимых процессов
σ ≡ diS / dt = –(1 / T) (dG / dt) > 0, (1.6)
или, что то же,
P ≡ Tσ = − dG/dt >0.
Одновременно
dG / dt < 0,
т. е. при спонтанной эволюции системы, как и следовало ожидать, происходит уменьшение ее потенциала Гиббса dG < 0. Таким образом, скорость производства энтропии и диссоциации энергии в открытой системе при постоянных температуре и давлении пропорциональна скорости уменьшения ее свободной энергии (термодинамического потенциала Гиббса).
В соответствии со сделанным предположением в рассматриваемой частично равновесной (по Т и р) системе единственной причиной необратимости, а значит и уменьшения ее потенциала Гиббса (dG < 0) и увеличения энтропии за счет внутренних процессов (diS > 0), являются химические реакции, самопроизвольное протекание которых приводит к изменению химического состава системы и соответствующему совершению работы. При протекании в системе стехиометрического химического превращения ij термализованных веществ-реагентов Аα, описываемого реакцией
и характеризуемого значением сродства Arij и скорости vij, выражение (1.6) преобразуется к виду
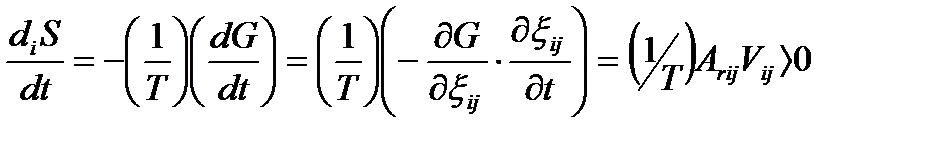 (1.7)
(1.7)
Здесь Аrij = –ΔrGij – текущее значение химического сродства, т. е. движущей силы этой химической реакции.Таким образом, скорость производства энтропии в сте-хиометрическом химическом процессе пропорциональна произведению значений движущей силы процесса (химического сродства реакций) и скорости реакции. Неравенство (1.7) является обязательным для всех термически инициированных элементарных процессов и свидетельствует о том, что направление самопроизвольного протекания элементарного химического превращения совпадает со знаком текущего значения сродства для этого превращения. Очевидно, что при протекании в системе одновременно нескольких элементарных превращений
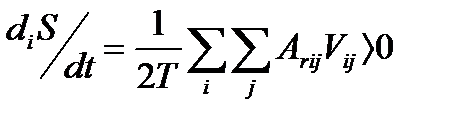 , (1.8)
, (1.8)
где суммирование ведется по всем реакционным группам. Коэффициент 1 2 использован во избежание повторного учета происходящих реакций при суммировании по двум индексам.
 2015-07-02
2015-07-02 875
875








