Реакційна здатність піролу, фурану та тіофену визначається наявністю в їх структурі циклу з π-електрононадлишковою ароматичною системою (шість β-електронів припадає на п'ять атомів циклу). Проте ступінь ароматичності згаданих гетероциклів нижча, ніж у бензолу, та залежить від природи гетероатома. Оскільки електронекативність атома сірки менша за електронегативність атомів азоту та кисню, ступінь участі неподіленої пари електронів атома сірки в утворенні ароматичного секстету молекули тіофену більший, ніж атома азоту в піролі та атома кисню у фурані. Так. якщо для бензолу енергія спряження становить 150 кДж/моль, то в ряду тіофен. пірол, фуран вона спадає в міру збільшення електронегативності гетероатома: тіофен (~130 кДж/моль), пірол (~110 кДж/моль), фуран (~90 кДж/моль). Тому, з наведених гетероциклів тіофен за своєю хімічною поведінкою найбільшою мірою нагадує бензол, а фуран має найменш виявлений ароматичний характер. У деяких реакціях фуран поводиться як ненасичена (дієнова) сполука.
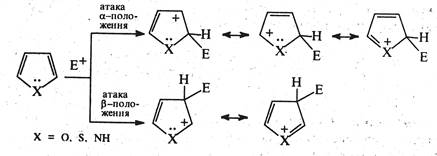
Внаслідок електронегативності гетероатома в молекулах піролу, фурану та тіофену, на відміну від бензолу, електронна густина розподілена нерівномірно, зокрема, на атомах вуглецю в α-положенні густина електронів вища, ніж у β-положенні. що визначає напрям проходження реакцій електрофільного заміщення.
А. Спільні хімічні властивості піролу, фурану та тіофену
1. Взаємодія з мінеральними кислотами. У присутності сильних мінеральних кислот пірол і фуран осмолюються. утворюючи полімерні продукти темного кольору. Ця властивість дістала назву ацидофобність, що означає «кислотобоязнь», від лаг. acidum — «кислота» та грец. фобос — «страх». Ацидофобність зумовлена приєднанням протона, переважно до α-вуглецевого атома циклу, що призводить до порушення ароматичності кільця. Потім відбувається або розрив циклу з утворенням полімеру (найвірогідніший процес для фурану), або полімеризація утвореної дієнової структури, яка відбувається зі збереженням циклу.
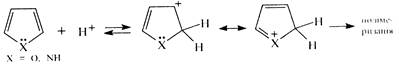
Введення у фуранове та пірольне ядро електроноакцепторних замісників (—NО2, — СООН, —СН=О) веде до зменшення ацидофобності цих сполук. Тіофен, на відміну від фурану та піролу, не виявляє ацидофобності. оскільки має стійку ароматичну структуру, яка не руйнується при дії чльних мінеральних кислот.
2. Реакції електрофільного заміщення. Будучи π-надлишковими ароматичними системами, пірол, фуран і тіофен легко вступають у характерні для ароматичних сполук реакції електрофільного заміщення. Ці реакції проходять значно легше, ніж у бензолу. За активністю у реакціях з електрофільними реагентами означені гетероцикли розташовуються в ряд: пірол > фуран > тіофен. У першу чергу заміщується атом водню при α-вуглецевому атомі та тільки якщо це положення зайняте, заміщення відбувається у β-положенні. Такий напрям заміщення зумовлений тим, що за участю α-вуглецевих атомів утворюється стійкіший σ-комплекс, завдяки більшій можливості для делокалізації позитивного заряду.
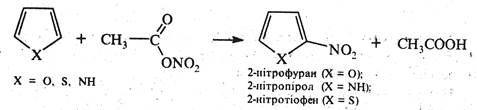
Нітрування. Враховуючи ацидофобність фурану та піролу, нітрування їх проводять не самою азотною кислотою, а продуктом взаємодії азотної кислоти з оцтовим ангідридом — ацетилнітратом СH3COONО2. Тіофен неацидофобний, тому його можна пронітрувати азотною кислотою за м'яких умов, однак частіше в реакції нітрування тіофецу також застосовують ацетилнітрат. У результаті нітрування утворюються α-нітросполуки.
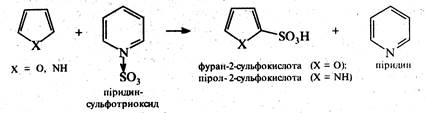
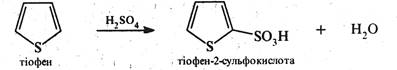
Сульфування. Для сульфування піролу та тіофену (ацидофобні речовини) замість сірчаної кислоти як електрофільнйй реагент використовують комплекс піридину з оксидом сірки (VI). — піридинсульфотриоксид C5H5N•S03. Цей сульфуючий реагент було запропоновано радянським хіміком О.П.Терентьєвим у 1947 р. У процесі реакції утворюються α-сульфокислоти.
Тіофен легко сульфується концентрованою сірчаною киелотоіо. Реакція проходить на холоду, майже з кількісним виходом. У цій реакції тіофен значно більш реакційноздатний, ніж бензол, який з сірчаною кислотою за цих умов не реагує. Дану реакцію використовують при очистці технічного бензолу від домішки тіофену.
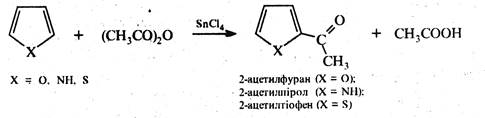
Ацилювання. Для ацилювання фурану та піролу як електрофільні реагенти використовують ангідриди кислот у присутності кислот Льюїса, частіше SnCl4 або ZnCl2. Тіофен ацилюється не тільки ангідридами, але і хлорангідридами карбонових кислот у присутності хлориду алюмінію. Заміщення здійснюється по α-положенню:
Галогенування. Галогенування фурану проходить доволі складно. Поряд зі заміщенням атомів водню на галоген у залежності від умов проведення реакції утворюються також продукти 2,5-приєднання.
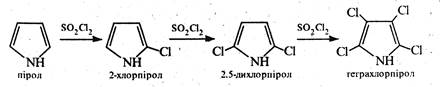
Пірол з галогенами реагує дуже легко, утворюючи тетрагалогенопіроли. Для добування моногалогенозаміщених похідних піролу потрібні спеціальні умови. Так, при дії на пірол сульфурилхлориду SО2C12 відбувається поступове заміщення атомів водню на галоген.
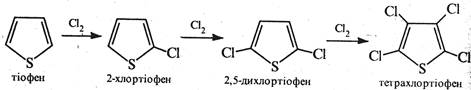
Галогенування тіофену проводять безпосередньою дією галогені (хлору або брому). Реакція проходить на холоду з утворенням моно-, ди-, три- та тетразаміщених похідних тіофену.
Реакція з йодом іде повільно у присутності каталізатора HgO.
3. Реакції відновлення. Фуран приєднує водень при високій температурі (140 °С) та тиску (100-150 атм.) у присутності каталізатори(нікель Ренея, паладій) з утворенням насиченого гетероциклу —тетрагідрофурану (оксолану).
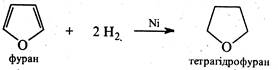
За хімічною будовою тетрагідрофуран являє собою циклічний простий ефір. Ця малореакційноздатна сполука широко використовується в органічному синтезі як розчинник.
Приєднання водню до тіофену в присутності паладієвого каталізатора відбувається значно легше, ніж до фурану (при кімнатній температурі та тиску 2-4 атм.). У процесі відновлення утворюється тетрагідротіофен.
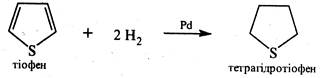
Пірол, на відміну від фурану та тіофену, гідрується воднем у момент виділення, наприклад, дією цинку в оцтовій кислоті. При цьому проходить часткове відновлення кільця з утворенням ненасиченого гетероциклу — 2,5-дигідропіролу (піроліну). Повне відновлення пірольного циклу відбувається при гідруванні над платиновим або паладієвим каталізатором. У результаті утворюється тетрагідропірол (піролідин):
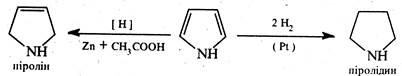
Піролін і піролідин є циклічними амінами та істотно відрізняються за хімічними властивостями від піролу.
У молекулі піроліну неподілена пара електронів не спряжена з π-електронами подвійного зв'язку, тому він виявляє властивості амінів і ненасичецих сполук. Піролідин же відноситься до насичених сполук —це типовий представник вторинних циклічних амінів. Піролідиновий цикл входить до складу багатьох природних сполук, таких, як алкалоїди, нікотин, кокаїн, атропін (див. гл. 4) та ін.
4. Реакції окислення. Фуран і пірол дуже чутливі до дії окислювачів і окислюються вже киснем повітря. При окисленні відбувається розрив гетероциклічного ядра та утворюються полімерні сполуки.
Проте, пропускання суміші фурану з повітрям над каталізатором V2О5 при температурі 320 °С приводить до утворення ангідриду малеїнової кислоти.
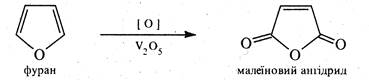
При окисленні піролу хромовою кислотою утворюється імід малеїнової кислоти.
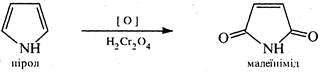
Тіофен дуже важко піддається окисленню.
5. Взаємні перетворення фурану, піролу та тіофену. Реакція проходить при температурі 450 °С у присутності каталізатора Аl2О3 (див. розд. 3.3.1, А).
Б. Специфічні хімічні властивості піролу та фурану
1. Пірол і його похідні. Будучи слабкою NH-кислотою (рКα ~17,5), пірол взаємодіє з металічним калієм, безводним гідроксидом калію, металічним натрієм і літієм у рідкому аміаку, з амідами калію та натрію, а також магнійорганічними сполуками, утворюючи солі.
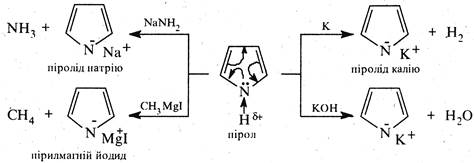
Аніон піролу, котрий входить до складу солей піролу (піролід-аніон) являє собою доволі стійку частинку внаслідок делокалізації негативного заряду по пірольному ядру.
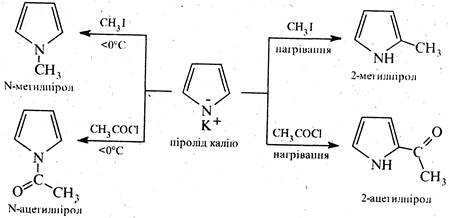
Солі піролу є реакційноздатними речовинами і широко застосовуються в органічному синтезі для введення у молекулу піролу алкільних і ацильних замісників. Причому, напрям реакцій алкілування й ацилування залежить від температури. При температурі нижчій 0°С утворюються N-алкіл- і, відповідно, N-ацилпіроли, при нагріванні - α-алкіл- і α-ацилпіроли, наприклад:
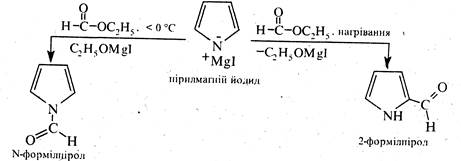
Поряд зі хлорангідридами карбонових кислот у реакціях ацилування можна використовувати складні ефіри. Так, при дії етилформіату на пірилмагніййодид на холоду утворюється N-формілпірол при нагріванні 2-формілпірол.
У деяких реакціях електрофільного заміщення пірол нагадує фенол, а його N-металічні похідні — феноксиди лужних металів. Зокрема, пірол, як і фенол, вступає в реакцію азосполучення.
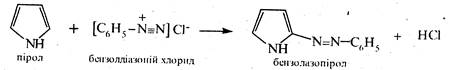
Піролід натрію формілується за умов реакції Раймера-Тімана (див. кн. 2, стор. 287),
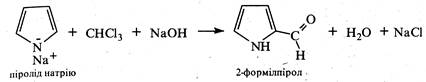
а також карбоксилується дією СО2 аналогічно реакції Кольбе-Шмітта для фенолу (див. кн. 2, стор. 286).
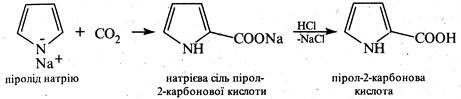
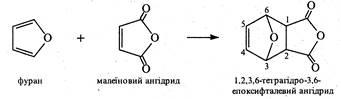
2. Фуран і його похідні. Займаючи проміжне положення між ароматичними сполуками та 1,3-дієнами, фуран вступає у характерну для спряжених дієнів реакцію Дільса-Альдера (див. кн. 2, стор. 57).Так, з малеїновим ангідридом він легко утворює відповідний продукт приєднання:
 2015-07-14
2015-07-14 8639
8639








